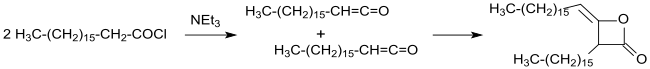Dimer alkiloketenu
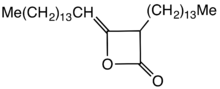
Dimery alkiloketenu (AKD) to rodzina związków organicznych opartych na 4-członowym układzie pierścieni oksetan-2-onu , który jest również centralnym elementem strukturalnym propiolaktonu i diketenu . Do pierścienia oksetanu technicznie odpowiednich dimerów ketenu alkilowego przyłączona jest grupa C12 – C16 alkilowa w pozycji 3 i grupa C13 – C17 alkilidenowa w pozycji 4.
Główne zastosowanie dimerów alkilowanych ketenów to zaklejanie papieru i tektury oraz hydrofobizacja włókien celulozowych . Produkty w ten sposób modyfikowane charakteryzują się wyższą wytrzymałością mechaniczną oraz mniejszą penetracją wody, tuszy czy farb drukarskich .
AKD zawierają hydrofobowe grupy alkilowe rozciągające się od pierścienia beta-propiolaktonu . Specyficzny przykład pochodzi z dimeryzacji ketenu kwasu stearynowego . Ten keten jest generowany przez pirolizę chlorku stearoilu. AKD reagują z grupami hydroksylowymi na celulozie poprzez estryfikacji . Estryfikacja jest konkurencyjna w stosunku do hydrolizy AKD. Przed opracowaniem AKD, hydrofobowość była nadawana przez włączenie kalafonii do papieru.
Powiązany z AKD jest bezwodnik alkenylobursztynowy (ASA). Jeśli chodzi o AKD, ASA reaguje z grupami hydroksylowymi celulozy, tworząc ester, zakotwiczając grupę hydrofobową na powierzchni. ASA otrzymuje się w reakcji enowej węglowodorów nienasyconych z bezwodnikiem maleinowym .
Historia
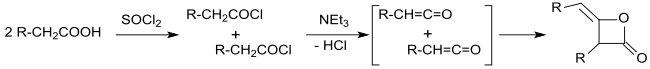
Już w 1901 roku Edgar Wedekind opublikował syntezę dimerów ketenu alkilowego w reakcji chlorków kwasów karboksylowych z trzeciorzędowymi aminami , produktami reakcji polimerów.
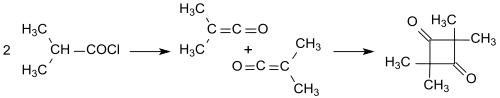
Masa cząsteczkowa określona przez wczesnych badaczy rzeczywiście wskazywała na wielokrotność grupy R 1 R 2 CH=C=O. Dlatego jako produkt reakcji np . chlorku izobutyrylu z trietyloaminą zaproponowano tzw. pironon (struktura diketonu z pierścieniem cyklobutanowym ) .
Pierwszorzędowe produkty reakcji chlorków kwasów karboksylowych z atomami wodoru w pozycji α i trzeciorzędowymi aminami zostały zidentyfikowane przez Hermanna Staudingera i Normana Thomasa Mortimera Wilsmore'a jako wysoce reaktywne keteny (etenony), które podczas dimeryzacji w [2] tworzą 2-oksetanony z grupą alkilidenową +2] fotocykloaddycje . To stopniowo przyniosło jasność co do składu alkilowanych dimerów ketenowych.
Wyjaśnienie konstytucji komplikowały różne produkty dimeryzacji ketenów. Na przykład prosty keten (H 2 C=C=O) dimeryzuje do diketenu (4-metylenooksetan-2-onu), podczas gdy podstawione keteny, takie jak dimetyloketen (Me 2 C =C=O, utworzony z izobutyrylu chlorek z trietyloaminą) dimeryzują w addycji od głowy do ogona do 2,2,4,4-tetrametylocyklobutanodionu .
2,2,4,4,4-tetrametylocyklobutanodion można łatwo izomeryzować do dimeru dimetyloketenu (4-izopropylideno-3,3-dimetylooksetan-2-onu).
Synteza i charakterystyka dimeru heksadecyloketenu, kluczowej substancji dla dimerów alkilowanych ketenów stosowanych w przemyśle papierniczym, została po raz pierwszy opisana w patencie z 1945 r. oraz w publikacji z 1947 r.
W badaniu kwantowo-chemicznym odrzucono tworzenie cyklobutanodionu podczas dimeryzacji n -alkiloketenu R-CH=C=O na rzecz tworzenia bardziej stabilnej termodynamicznie struktury oksetan-2-onu.
Przygotowanie
Przemysłowa synteza alkilowanych ketenodimerów (wówczas nazywanych jeszcze ketoetenonami) została opatentowana w 1945 roku z długołańcuchowych chlorków kwasów karboksylowych w obojętnych rozpuszczalnikach (takich jak eter dietylowy lub benzen ) z trietyloaminą jako trzeciorzędową aminą w warunkach bezwodnych. Po odsączeniu nierozpuszczalnego chlorowodorku trietyloaminy i odparowaniu rozpuszczalnika otrzymuje się dimery długołańcuchowych alkili z wydajnością powyżej 90%.
Zastosowanie innych rozpuszczalników, takich jak estry kwasów karboksylowych lub ketony do łatwiejszego rozdzielania chlorowodorków trialkiloamin lub innych amin, takich jak N,N,N',N'- tetrametylo-heksan-1,6-diamina nie daje znaczących korzyści .
Opisano również procesy bez użycia rozpuszczalnika, w których otrzymany chlorowodorek aminy albo odsącza się, albo ekstrahuje rozcieńczonymi wodnymi kwasami.
Ciągły proces, w którym chlorek kwasu karboksylowego o długim łańcuchu i trzeciorzędowa amina (np. dimetyloizopropyloamina, dimetylocykloheksyloamina lub trietyloamina) są dostarczane oddzielnie bez rozpuszczalników do reaktora rurowego, ugniatarki lub najlepiej do wytłaczarki dwuślimakowej lub planetarnej wytłaczarki rolkowej i poddawane reakcji w temperaturach od 90 i 110°C, dostarcza ponad 90% zawartości laktonu przy krótkich czasach reakcji. Przetwarzanie odbywa się poprzez rozdzielanie faz lub ekstrakcję kwasową.
Używać
Dimery alkilowanych ketenów jako środki zaklejające do papieru
problemy z kwaśnym (za pośrednictwem siarczanu glinu) zaklejaniem masą papieru żywicami kalafoniowymi trawionymi alkaliami doprowadziły oprócz stosowania flokulantów alkalicznych (takich jak kreda lub węglan wapnia jako rezerwa alkaliczna) do poszukiwania alternatywne materiały do zaklejania w środowisku neutralnym lub zasadowym. Oprócz znacznie bardziej reaktywnych bezwodników alkenylobursztynowych (które również szybko hydrolizują w obecności wody), alkilowane dimery ketenowe zaczęły być preferowanymi środkami powierzchniowymi i masowymi w przemyśle papierniczym od lat sześćdziesiątych XX wieku, począwszy od lat pięćdziesiątych XX wieku.
Przemysłowo stosowane AKD pochodzą z kwasów tłuszczowych o długości łańcucha od C14 ( kwas mirystynowy ) do C22 ( kwas behenowy ); korzystnie stosuje się palmitylo(C16)diketen i stearylo(C18)keten i ich mieszaniny, jak również mieszaniny kwasów tłuszczowych z hydrolizy tłuszczów zwierzęcych i roślinnych. Ze względu na długość łańcucha pierwotnych kwasów tłuszczowych, AKD są woskowatymi ciałami stałymi o temperaturze topnienia między 42 a około 70°C. Mieszaniny dimerów alkilowanych ketenów i wody są dyspersjami w temperaturach poniżej 40°C lub emulsjami w temperaturach powyżej 45°C. Płynne AKD nie są szeroko stosowane, bazują na nienasyconych kwasach tłuszczowych, takich jak kwas oleinowy lub rozgałęzionych, takich jak kwas izostearynowy.
Wodne dyspersje alkilodiketenów na ogół zawierają 10-20% wag. AKD, jak również aktywne koloidy ochronne (zwłaszcza polikationy , takie jak skrobia kationowa, kopolimery N -winylopirolidonu i czwartorzędowanego N - winyloimidazolu, acylowane polietylenoiminy lub kationowe poliakrylamidy o dużej masie cząsteczkowej o średniej masie molowej do 7 milionów g/mol) i inne stabilizatory (zwykle anionowe środki powierzchniowo czynne, na przykład ligninosulfoniany lub produkty kondensacji soli sodowej kwasu naftalenosulfonowego i formaldehydu ). Takie stabilizowane dyspersje AKD są aktywne i stabilne w temperaturze pokojowej do trzech miesięcy, a także tolerują dodatek różnych wypełniaczy do papieru lub tektury (np. kaolin , kreda, talk, dwutlenek tytanu , siarczan wapnia , tlenek glinu itp.) od 5 do 25%. Ilości dimerów alkiloketenowych stosowanych do zaklejania papieru i wyrobów papierowych mieszczą się korzystnie w zakresie od 0,15 do 0,8% wagowych, czasem od 0,05 do 0,2% wagowych, w przeliczeniu na suchą masę papierniczą.
Zaklejanie papieru dimerami alkilowanych ketenów
W przypadku formatowania papieru za pomocą AKD zaproponowano trzyetapowy proces, który pomimo kontrowersyjnych dyskusji w latach 90. wydaje się najlepiej opisywać zachodzące procesy i wyjaśniać osiągane wyniki. Decydującymi kryteriami jakości hydrofobowości papierów są
- zatrzymywanie cząstek AKD na mokrej masie papierowej na sicie papierowym
- rozprzestrzeniania się cząstek AKD na powierzchni i wnikania w masę papierową
- reakcja chemiczna grup hydroksylowych celulozy ( estryfikacja ) z dimerami alkilowanych ketenów z wytworzeniem estrów beta-ketokarboksylowych.
Struktura cząsteczkowa (tj. masa molowa i stopień usieciowania), gęstość ładunku molowego grup kationowych, dokładne dawkowanie polimeru kationowego jako stabilizatora dyspersji i środka wspomagającego retencję oraz zachowanie innych parametrów procesu, takich jak temperatura, pH i czas pobytu jest kluczowy.
Po usunięciu nadmiaru wody - również w celu uniknięcia hydrolizy AKD do beta-ketokwasu i późniejszej dekarboksylacji do ketonu -
następuje po pękaniu stabilizowanych cząstek AKD na masie bazowej papieru, topnieniu stałego wosku AKD (w temperaturze ok. 90°C), rozprowadzaniu ciekłego wosku AKD przez dyfuzję powierzchniową na włóknach celulozowych i tworzeniu zamkniętych hydrofobowych warstwy. Grubość warstw hydrofobowych zależy od stężenia AKD w dyspersji.
Ad 3. Hydrofobowanie włókien celulozowych dimerami alkilowanych ketenów zachodzi najefektywniej w środowisku obojętnym lub najlepiej słabo zasadowym (pH 7,5-9,0). Temperatura reakcji wynosi na ogół 90-110°C, przy czym około 40% użytego AKD reaguje z celulozą. Po reakcji zmierzono kąty zwilżania >100°, co wskazuje na hydrofobowy charakter powierzchni modelu zmodyfikowanego AKD. Estryfikację grup hydroksylowych włókien celulozowych wykazano również w reakcjach porównawczych ze znakowaną 14C AKD .
Klejenie z AKD nadaje się do trwałej hydrofobizacji papieru gazetowego, drukarskiego i piśmienniczego oraz tektury stosowanej jako pojemnik na płyny (w tym artykuły spożywcze, takie jak mleko), a także do poprawy stabilności kształtu i płynności.
Literatura
- Roberts, JC (1996), JC Roberts (red.), Paper Chemistry, wydanie 2 , Londyn: Chapman & Hall, ISBN 978-0-7514-0236-0
- Johnson, D. (2009), I. Thorn, CO Au (red.), Applications of Wet-End Paper Chemistry, wydanie 2 , Springer Netherlands, s. 73–112, ISBN 978-1-4020-6037-3
- ^ „AKD, dimer alkiloketenu” .
- ^ Raimund Miller, Claudio Abaecherli, Adel Said, Barry Jackson "Ketenes" w Ullmann's Encyclopedia of Industrial Chemistry, 2001, Wiley-VCH, Weinheim. doi : 10.1002/14356007.a15_063
- ^ Werner J. Auhorn „Papier i tektura, 3. Dodatki chemiczne” w Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim. 2012. doi : 10.1002/14356007.o18_o11
- ^ Gess, Hieronim; Rozdarcie, Dominik (2005). „Bezwodnik alkenylobursztynowy (ASA)”. Dziennik TAPPI . 4 : 25–30.
- ^ Wedekind, Edgar (maj 1901). „Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen” [O zakwaszaniu bezwodników kwasowych przy użyciu amin trzeciorzędowych]. Berichte der Deutschen Chemischen Gesellschaft (w języku niemieckim). 34 (2): 2070–2077. doi : 10.1002/cber.190103402122 .
- ^ Wedekind, Edgar (1902). „Ueber das Verhalten einiger Säurechloride bei der Chlorwasserstoffentziehung” [O zachowaniu niektórych chlorków kwasowych przy odstawianiu chlorowodoru]. Annalen der Chemie Justusa Liebiga (w języku niemieckim). 323 (2): 246–257. doi : 10.1002/jlac.19023230206 .
- ^ a b Wedeking, E .; Weisswange, W. (marzec 1906). „Ueber die Synthese eines Diketons der Cyclobutanreihe” [O syntezie diketonu z serii cyklobutanu]. Berichte der Deutschen Chemischen Gesellschaft (w języku niemieckim). 39 (2): 1631–1646. doi : 10.1002/cber.19060390287 .
- Bibliografia _ Haussermann, J.; Weisswange, W.; Miller, M. (1911). „Pyrononsynthesen mit Hilfe der Tertiärbasenreaktion II” [Syntezy pirononu z wykorzystaniem trzeciorzędowej reakcji barwnikowej II]. Annalen der Chemie Justusa Liebiga (w języku niemieckim). 378 (3): 261–292. doi : 10.1002/jlac.19113780302 .
- ^ Staudinger, Hermann (marzec 1905). „Ketene, eine neue Körperklasse” [Ketene, nowa klasa ciała]. Berichte der Deutschen Chemischen Gesellschaft (w języku niemieckim). 38 (2): 1735–1739. doi : 10.1002/cber.19050380283 .
- Bibliografia _ Klever, HW (styczeń 1907). „Über Ketene. 5. Mitteilung. Reaktionen des Dimethylketens” [O ketenach. 5. Komunikacja. Reakcje dimetyloketenu]. Berichte der Deutschen Chemischen Gesellschaft (w języku niemieckim). 40 (1): 1149–1153. doi : 10.1002/cber.190704001170 .
- Bibliografia _ Stewart, AW (styczeń 1908). „Keten. Bemerkungen zu der Abhandlung der HHrn. Staudinger und Klever” [Ketene. Uwagi do traktatu HHrn. Staudingera i Klevera]. Berichte der Deutschen Chemischen Gesellschaft (w języku niemieckim). 41 (1): 1025–1027. doi : 10.1002/cber.190804101202 .
- Bibliografia _ Otto, Piotr (wrzesień 1968). „Mechanizm dimeryzacji dimetyloketenu”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 90 (19): 5342–5343. doi : 10.1021/ja01021a090 .
- ^ „DIMER β-LAKTONU DIMETYLOKETENU” . Syntezy organiczne . doi : 10.15227/orgsyn.048.0072 .
- ^ a b US 2369919 , JC Sauer, „Ketoetenony i ich proces”, opublikowane 20.02.1945, przypisane do EI du Pont de Nemours & Co.
- ^ Sauer, JC (październik 1947). „Dimery ketenowe z halogenków kwasowych”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 69 (10): 2444–2448. doi : 10.1021/ja01202a058 .
- Bibliografia _ Li, Guoneng; Hu, Guilin; Słońce, Yaoyu (2013). „Teoretyczne badania nad mechanizmem reakcji dimeryzacji alkiloketenu” . Dziennik Chemii . 2013 : 1–5. doi : 10.1155/2013/481586 .
- ^ US 7960497 , DA Gerstenhaber, „Preparation of alkiloketen dimers”, opublikowany 2011-06-14, przypisany do Hercules Inc.
- ^ US 5344943 , N. Brolund, „Długołańcuchowe dimery ketenu”, opublikowane 1994-09-06, przypisane do Akzo Nobel BV
- ^ a b WO 03045936 , R. Ettl, M. Winter, T. Freund, T. Kessler, G. Grimm, „Metoda wytwarzania dimerów alkiloketenu”, opublikowany 2003-6-5, przydzielony BASF AG
- ^ US 2627477 , WF Downey, „Emulsja dimeru wyższego alkiloketenu”, opublikowana 1953-02-03, przypisana do Hercules Powder Co.
- ^ WO 2007141197 , C. Hamers, A. Brockmeyer, M. Schmid, K. Lorenz, U. Riebeling, „Wodne dyspersje dimerów alkiloketenu”, opublikowane 13.12.2007, przekazane BASF AG
- ^ a b c Lindström, T .; Larsson, T. (2005), STFI-Packfors (red.), Notatka na temat wymiarowania AKD: badanie rzeczywistych i pozornych sprzeczności w literaturze dotyczącej rozprzestrzeniania/dyfuzji AKD na celulozie, Raport nr. 81 (PDF)
- ^ Lindfors, J.; Sahmi, J.; Laine, J.; Stenius, P. (2007), „Powierzchnie modeli AKD i ASA: przygotowanie i charakteryzacja” (PDF) , BioResources , tom. 2, nie. 4, s. 652–670