Domena fosfotransferowa histydyny
| Domena fosfotransferu histydyny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
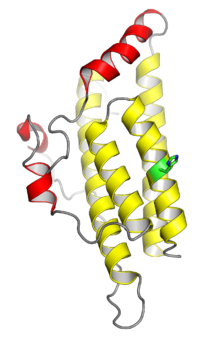 Struktura krystaliczna drożdżowego białka fosfotransferazy histydynowej Ypd1. Cztery helisy pokazane na żółto obejmują konserwatywną wiązkę czterech helis typową dla monomerycznych domen HPt; helisy pokazane na czerwono to insercje specyficzne dla Ypd1. Miejsce fosforylacji histydyny zaznaczono na zielono. od .
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Hpt | ||||||||
| Pfam | PF01627 | ||||||||
| InterPro | IPR008207 | ||||||||
| MĄDRY | HPT | ||||||||
| PROZYTA | PS50894 | ||||||||
| |||||||||
| Fosfotransferaza histydynowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura krystaliczna białka fosfotransferazy histydynowej Caulobacter crescentus ChpT w formie dimerycznej. Cztery helisy pokazane na żółto obejmują konserwatywną wiązkę czterech helis, z miejscami fosforylacji histydyny podświetlonymi na zielono. Domeny pokazane na czerwono i jasnobrązowo to domeny pseudo-CA, które przypominają domeny wiążące ATP kinaz histydynowych, ale nie wiążą ani nie hydrolizują ATP. od .
| |||||||||
| Identyfikatory | |||||||||
| Symbol | HPTransfase | ||||||||
| Pfam | PF10090 | ||||||||
| InterPro | IPR018762 | ||||||||
| |||||||||
Domeny fosfotransferowe histydyny i fosfotransferazy histydynowe (obie często określane skrótem HPt ) są domenami białkowymi zaangażowanymi w postać „fosforelay” dwuskładnikowych systemów regulacyjnych . Białka te posiadają ulegającą fosforylacji resztę histydyny i są odpowiedzialne za przeniesienie grupy fosforylowej z reszty asparaginianu na pośrednią domenę „odbiorcy” , zazwyczaj część hybrydowej kinazy histydynowej , do asparaginianu na ostateczny regulator odpowiedzi .
Funkcjonować
W ortodoksyjnej sygnalizacji dwuskładnikowej białko kinazy histydynowej autofosforyluje resztę histydynową w odpowiedzi na sygnał zewnątrzkomórkowy, a grupa fosforylowa jest następnie przenoszona do reszty asparaginianowej w domenie odbiorczej regulatora odpowiedzi . W fosforelayach „hybrydowa” kinaza histydynowa zawiera wewnętrzną domenę odbiorczą zawierającą asparaginian, do której przenoszona jest grupa fosforylowa, po czym białko HPt zawierające histydynę ulegającą fosforylacji otrzymuje grupę fosforylową i ostatecznie przenosi ją do regulatora odpowiedzi. W ten sposób system przekaźników postępuje w kolejności His-Asp-His-Asp, z drugim His wniesionym przez Hpt. W niektórych przypadkach system fosforelay jest zbudowany z czterech oddzielnych białek, a nie z hybrydowej kinazy histydynowej z wewnętrzną domeną odbiorczą, aw innych przykładach zarówno domena odbiorcza, jak i domeny HPt są obecne w łańcuchu polipeptydowym kinazy histydynowej. Spis dwuskładnikowej architektury domen systemowych wykazał, że domeny HPt w bakteriach są bardziej powszechne jako domeny większych białek niż jako pojedyncze białka.
Rozporządzenie
Zwiększona złożoność systemu fosforelay w porównaniu z ortodoksyjną sygnalizacją dwuskładnikową zapewnia dodatkowe możliwości regulacji i poprawia specyficzność odpowiedzi. Chociaż istnieje bardzo mało przesłuchów między ortodoksyjnymi systemami dwuskładnikowymi, fosforoprzekaźniki umożliwiają bardziej złożone ścieżki sygnałowe; przykłady obejmują rozwidlony szlak z wieloma wyjściami w dół, jak w przypadku Caulobacter crescentus ChpT HPt zaangażowany w regulację cyklu komórkowego lub, alternatywnie, szlaki, w których więcej niż jedna kinaza histydynowa kontroluje pojedynczy regulator odpowiedzi, taki jak sporulacja u Bacillus subtilis , co może prowadzić do złożonych zmian czasowych. W niektórych znanych przypadkach istnieje dodatkowa forma regulacji fosfatazy fosfohistydynowej , które działają na HPt, takich jak białko SixA Escherichia coli , które celuje w ArcB.
Struktura

Funkcja fosfotransferu histydyny może być realizowana przez białka o co najmniej dwóch różnych architekturach, obie złożone z wiązki czterech helis, ale różniące się sposobem złożenia wiązki. Większość strukturalnie scharakteryzowanych białek HPt, takich jak domena Hpt z Escherichia coli i białka Ypd1 Saccharomyces cerevisiae , tworzy wiązkę jako monomery. W mniej powszechnym typie, takim jak sporulacji Spo0B z Bacillus subtilis lub białko ChpT z Caulobacter crescentus , wiązka jest składana jako dimer białkowy , o budowie zbliżonej do kinaz histydynowych. Monomeryczne domeny HPt posiadają tylko jedną resztę histydyny ulegającą fosforylacji i oddziałują z jednym regulatorem odpowiedzi, podczas gdy dimery mają dwa miejsca fosforylacji i mogą oddziaływać jednocześnie z dwoma regulatorami odpowiedzi. Monomeryczne domeny HPt nie mają własnej aktywności enzymatycznej i działają wyłącznie jako transportery fosforanowe, podczas gdy dimeryczny Spo0B jest katalityczny; jego szybkość transferu fosfo do regulatora odpowiedzi biorcy jest znacznie przyspieszona w porównaniu z fosforanem histydyny. Pomimo posiadania drugiej domeny z pewnym podobieństwem do ATPazy domeny, nie wykazano, aby dimeryczne białka HPt wiązały lub hydrolizowały ATP i brakuje im kluczowych reszt obecnych w innych ATPazach.
Formy monomeryczne i dimeryczne nie mają wykrywalnego podobieństwa sekwencji i najprawdopodobniej nie są spokrewnione ewolucyjnie; zamiast tego są przykładami zbieżnej ewolucji . Chociaż dimeryczne HPt prawdopodobnie pochodzą ze zdegenerowanych kinaz histydynowych, możliwe jest, że monomeryczne HPt mają wiele różnych źródeł, ponieważ istnieje niewiele ograniczeń ewolucyjnych dotyczących struktury.
Dystrybucja
W bakteriach , gdzie dwuskładnikowa sygnalizacja jest niezwykle powszechna, około 25% znanych kinaz histydynowych jest typu hybrydowego. Systemy dwuskładnikowe są znacznie rzadsze u archeonów i eukariontów i występują u niższych eukariontów i roślin, ale nie u wielokomórkowców . Wśród znanych przykładów większość, jeśli nie wszystkie, dwuskładnikowe systemy eukariotyczne to hybrydowe przekaźniki kinazowe.
Bioinformatyczny spis genomów bakteryjnych wykazał duże różnice w liczbie (monomerycznych) domen HPt zidentyfikowanych w różnych typach bakterii , przy czym niektóre genomy w ogóle nie kodują HPt. W stosunku do liczby kinazy histydynowej i regulatorów odpowiedzi obecnych w genomie, eukarionty mają bardziej identyfikowalne domeny HPt niż bakterie. U grzybów inwentarz genomowy białek HPt jest różny, przy czym grzyby nitkowate mają na ogół więcej białek HPt niż drożdże ; tylko jeden jest zakodowany w dobrze scharakteryzowanym Saccharomyces cerevisiae . Rośliny na ogół mają więcej niż jeden HPt, ale mniej HPt niż regulatory odpowiedzi.