Dziedzina asocjacji topologicznej

Domena asocjacyjna topologicznie (TAD) to samooddziałujący region genomowy, co oznacza, że sekwencje DNA w TAD fizycznie oddziałują ze sobą częściej niż z sekwencjami poza TAD. Mediana wielkości TAD w komórkach myszy wynosi 880 kb i mają one podobne rozmiary u gatunków innych niż ssaki. Granice po obu stronach tych domen są zachowane między różnymi typami komórek ssaków, a nawet między gatunkami i są silnie wzbogacone o czynnik wiążący CCCTC (CTCF) i kohezynę . Ponadto niektóre typy genów (takie jak transfer RNA geny i geny porządkowe ) pojawiają się w pobliżu granic TAD częściej, niż można by się spodziewać przypadkowo.
Funkcje TAD nie są w pełni zrozumiałe i nadal są przedmiotem dyskusji. Większość badań wskazuje, że TAD regulują ekspresję genów poprzez ograniczenie interakcji wzmacniacz - promotor do każdego TAD, jednak ostatnie badanie oddziela organizację TAD i ekspresję genów. Stwierdzono, że zakłócenie granic TAD jest związane z szerokim zakresem chorób, takich jak rak , różne wady rozwojowe kończyn, takie jak synpolidaktylia , zespół Cooksa i zespół F oraz szereg zaburzeń mózgu, takich jak niedorozwój ciała modzelowatego i demielinizacyjna leukodystrofia o początku w wieku dorosłym.
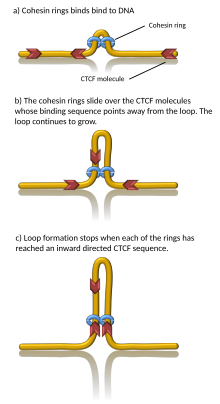
Mechanizmy leżące u podstaw tworzenia TAD są również złożone i nie zostały jeszcze w pełni wyjaśnione, chociaż wiele kompleksów białkowych i elementów DNA jest związanych z granicami TAD. Jednak model kajdanek i model wytłaczania pętli opisują tworzenie TAD za pomocą białek CTCF i kohezyny. Ponadto zaproponowano, że sama sztywność granic TAD może powodować izolację domeny i powstawanie TAD.
Odkrycie i różnorodność
TAD definiuje się jako regiony, których sekwencje DNA preferencyjnie kontaktują się ze sobą. Zostały odkryte w 2012 roku przy użyciu technik wychwytywania konformacji chromosomów, w tym Hi-C . Wykazano, że są obecne w wielu gatunkach, w tym muszkach owocowych ( Drosophila ), myszach , roślinach, grzybach i ludzkich genomach. U bakterii są one określane jako domeny oddziałujące na chromosomy (CID).
Narzędzia analityczne i bazy danych
Lokalizacje TAD są definiowane przez zastosowanie algorytmu do danych Hi-C. Na przykład TAD są często nazywane zgodnie z tak zwanym „indeksem kierunkowości”. Wskaźnik kierunkowości jest obliczany dla poszczególnych pojemników 40 kb, zbierając odczyty, które mieszczą się w pojemniku, i obserwując, czy ich sparowane odczyty mapują się w górę, czy w dół pojemnika (pary odczytów muszą obejmować nie więcej niż 2 MB). Wartość dodatnia wskazuje, że więcej par odczytu znajduje się w dół niż w górę, a wartość ujemna wskazuje na odwrotność. Z matematycznego punktu widzenia wskaźnik kierunkowości jest statystyką chi-kwadrat ze znakiem.
Rozwój wyspecjalizowanych przeglądarek genomu i narzędzi do wizualizacji, takich jak Juicebox, HiGlass/HiPiler, The 3D Genome Browser, 3DIV, 3D-GNOME i TADKB, umożliwił nam wizualizację organizacji TAD interesujących regionów w różnych typach komórek.
Mechanizmy powstawania
Wiadomo, że wiele białek jest związanych z tworzeniem TAD, w tym białko CTCF i białkowy kompleks kohezyny . Nie wiadomo również, jakie komponenty są wymagane na granicach TAD; jednakże w komórkach ssaków wykazano, że te regiony graniczne mają stosunkowo wysoki poziom wiązania CTCF. Ponadto niektóre typy genów (takie jak przenoszącego RNA i geny porządkowe ) pojawiają się w pobliżu granic TAD częściej, niż można by się spodziewać przypadkowo.
Symulacje komputerowe wykazały, że wytłaczanie pętli chromatyny napędzane silnikami kohezyny może generować TAD. W modelu wytłaczania pętli kohezyna wiąże chromatynę, wciąga ją i wytłacza chromatynę, aby stopniowo tworzyć pętlę. Chromatyna po obu stronach kompleksu kohezyny jest wytłaczana, aż kohezyna napotka białko CTCF związane z chromatyną, zwykle zlokalizowane na granicy TAD. W ten sposób granice TAD można połączyć jako kotwice pętli chromatyny. Rzeczywiście, in vitro zaobserwowano, że kohezyna procesowo wytłacza pętle DNA w sposób zależny od ATP i zatrzymuje się w CTCF. Co ważne, ponieważ kohezyny mogą dynamicznie odłączać się od chromatyny, model ten sugeruje, że TAD (i związane z nimi pętle chromatyny) są dynamicznymi, przejściowymi strukturami, zgodnie z obserwacjami in vivo.
Sugerowano inne mechanizmy powstawania TAD. Na przykład niektóre symulacje sugerują, że superskręcenie generowane przez transkrypcję może przenosić kohezynę do granic TAD lub że pasywnie dyfundujące „poślizgowe łącza” kohezyny mogą generować TAD.
Nieruchomości
Ochrona
Doniesiono, że TAD są względnie stałe między różnymi typami komórek (na przykład w komórkach macierzystych i komórkach krwi), a nawet między gatunkami w określonych przypadkach.
Relacje z kontaktami promotor-wzmacniacz
Większość obserwowanych interakcji między promotorami i wzmacniaczami nie przekracza granic TAD. Usunięcie granicy TAD (na przykład użycie CRISPR do usunięcia odpowiedniego regionu genomu) może umożliwić utworzenie nowych kontaktów promotor-wzmacniacz. Może to wpływać na ekspresję genów w pobliżu – wykazano, że taka nieprawidłowa regulacja powoduje wady rozwojowe kończyn (np. polidaktylia ) u ludzi i myszy.
Symulacje komputerowe wykazały, że superskręcenie włókien chromatyny wywołane transkrypcją może wyjaśnić, w jaki sposób powstają TAD i jak mogą one zapewnić bardzo wydajne interakcje między wzmacniaczami i ich pokrewnymi promotorami zlokalizowanymi w tym samym TAD.
Związek z innymi cechami strukturalnymi genomu
Wykazano, że domeny czasu replikacji są powiązane z TAD, ponieważ ich granica jest zlokalizowana razem z granicami TAD, które znajdują się po obu stronach przedziałów. Proponuje się, aby izolowane sąsiedztwa , pętle DNA utworzone przez regiony związane z CTCF / kohezyną, funkcjonalnie leżały u podstaw TAD.
Rola w chorobie
Zakłócenie granic TAD może wpływać na ekspresję pobliskich genów, a to może powodować choroby.
Na przykład doniesiono, że genomowe warianty strukturalne, które zakłócają granice TAD, powodują zaburzenia rozwojowe, takie jak wady rozwojowe kończyn ludzkich. Ponadto kilka badań dostarczyło dowodów na to, że przerwanie lub przegrupowanie granic TAD może zapewnić korzystny wzrost w przypadku niektórych nowotworów, takich jak ostra białaczka limfoblastyczna z komórek T (T-ALL), glejaki i rak płuc.
Domeny związane z blaszką
Domeny związane z blaszką (LAD) to części chromatyny, które silnie oddziałują z blaszką, podobną do sieci strukturą na wewnętrznej błonie jądra . LAD składają się głównie z transkrypcyjnie cichej chromatyny, wzbogaconej trimetylowanym Lys27 na histonie H3 (tj. H3K27me3 ); która jest powszechną posttranslacyjną modyfikacją histonów heterochromatyny . LAD mają miejsca wiążące CTCF na swoich obrzeżach.