Fluorescencyjna spektroskopia korelacji krzyżowej
Spektroskopia korelacji krzyżowej fluorescencji ( FCCS ) została wprowadzona przez Eigena i Riglera w 1994 r. I zrealizowana eksperymentalnie przez Schwille'a w 1997 r. Zasadniczo jest to rozszerzenie procedury spektroskopii korelacji fluorescencji (FCS) poprzez wykorzystanie dwóch różnie zabarwionych cząsteczek zamiast jednej. Innymi słowy, zbieżne fluktuacje natężenia zielonego i czerwonego różnych cząsteczek są skorelowane z tym, czy cząstki oznakowane na zielono i czerwono poruszają się razem przez określoną objętość konfokalną. W rezultacie FCCS zapewnia wysoce czuły pomiar interakcji molekularnych, niezależny od szybkości dyfuzji. Jest to ważny postęp, biorąc pod uwagę, że szybkość dyfuzji zależy tylko w niewielkim stopniu od wielkości kompleksu molekularnego.
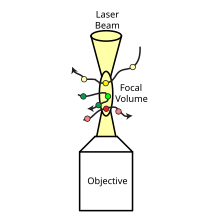
FCCS wykorzystuje dwa gatunki, które są niezależnie znakowane za pomocą dwóch różnokolorowych sond fluorescencyjnych. Te sondy fluorescencyjne są wzbudzane i wykrywane przez dwa różne źródła światła laserowego i detektory, zwykle oznaczone jako „zielony” i „czerwony”. Zwykle stosuje się mikroskop konfokalny , aby uzyskać nakładające się zielone i czerwone ogniskowe objętości do wzbudzenia.
Znormalizowana funkcja korelacji krzyżowej jest zdefiniowana dla dwóch gatunków fluorescencyjnych i , które są niezależnymi kanałami zielonym, G i czerwonym, R w następujący sposób: sol {\ displaystyle \ G
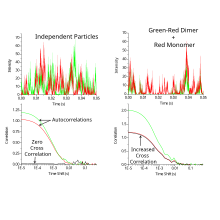
gdzie różnicowe sygnały fluorescencyjne czasie i w czasie opóźnienia, ja sol później jest ze sobą skorelowane. W przypadku braku przenikania widmowego funkcja korelacji krzyżowej wynosi zero dla cząstek nieoddziałujących. W przeciwieństwie do FCS, funkcja korelacji krzyżowej wzrasta wraz ze wzrostem liczby oddziałujących cząstek.
FCCS jest wykorzystywany przede wszystkim do pomiarów interakcji biomolekularnych zarówno w żywych komórkach, jak i in vitro. Można go wykorzystać do pomiaru prostych stechiometrii molekularnych i stałych wiązania. Jest to jedna z niewielu technik, które mogą dostarczyć informacji o interakcjach białko-białko w określonym czasie i miejscu w żywej komórce. W przeciwieństwie do przenoszenia energii rezonansu fluorescencji , nie ma ograniczenia odległości dla interakcji. W rezultacie można go wykorzystać do sondowania dużych kompleksów. Niemniej jednak wymaga to, aby kompleksy aktywnie dyfundowały przez ognisko mikroskopu w stosunkowo krótkiej skali czasu (zwykle sekundy).
Modelowanie
Krzywe korelacji krzyżowych są modelowane według nieco bardziej skomplikowanej funkcji matematycznej niż stosowana w FCS. Przede wszystkim efektywna nałożona objętość obserwacji, w której kanały G i R tworzą pojedynczą objętość obserwacji w rozwiązaniu:
gdzie i są promieniowe parametry i i odpowiednio dla kanałów G i R. z
Czas dyfuzji dla podwójnie ( i R) fluorescencyjnych gatunków jest zatem opisany następująco:
gdzie cząstki podwójnie fluorescencyjnej
Krzywą korelacji krzyżowej wygenerowaną z dyfuzji podwójnie znakowanych cząstek fluorescencyjnych można modelować w oddzielnych kanałach w następujący sposób:
W idealnym przypadku funkcja korelacji krzyżowej jest proporcjonalna do stężenia podwójnie znakowanego kompleksu fluorescencyjnego:
z
Amplituda korelacji krzyżowej jest wprost proporcjonalna do stężenia podwójnie znakowanych (czerwonych i zielonych) form
Zobacz też
Linki zewnętrzne
- Korelacja krzyżowa fluorescencji (FCCS) (Becker & Hickl GmbH, strona internetowa)