Fototropizm
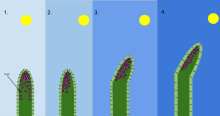
Fototropizm to wzrost organizmu w odpowiedzi na bodziec świetlny. Fototropizm najczęściej obserwuje się u roślin , ale może również występować u innych organizmów, takich jak grzyby . Komórki rośliny znajdujące się najdalej od światła zawierają hormon zwany auksyną , który reaguje, gdy pojawia się fototropizm. Powoduje to, że roślina ma wydłużone komórki po najdalszej stronie od światła. Fototropizm jest jednym z wielu tropizmów roślin lub ruchy, które reagują na bodźce zewnętrzne. Wzrost w kierunku źródła światła nazywany jest fototropizmem dodatnim, podczas gdy wzrost w kierunku od światła nazywany jest fototropizmem ujemnym. Negatywnego fototropizmu nie należy mylić ze skototropizmem, który definiuje się jako wzrost w kierunku ciemności, podczas gdy negatywny fototropizm może odnosić się do wzrostu z dala od źródła światła lub w kierunku ciemności. Większość pędów roślin wykazuje pozytywny fototropizm i przestawia swoje chloroplasty w liściach, aby zmaksymalizować energię fotosyntezy i promować wzrost. Niektóre wierzchołki pędów winorośli wykazują negatywny fototropizm, co pozwala im rosnąć w kierunku ciemnych, stałych obiektów i wspinać się po nich. Połączenie fototropizmu i grawitropizmu pozwala roślinom rosnąć we właściwym kierunku.
Mechanizm
Istnieje kilka cząsteczek sygnałowych , które pomagają roślinie określić, skąd pochodzi źródło światła, a te aktywują kilka genów, które zmieniają gradienty hormonów, umożliwiając roślinie wzrost w kierunku światła. Sam wierzchołek rośliny jest znany jako koleoptyl , który jest niezbędny do wykrywania światła. Środkowa część koleoptylu to obszar, w którym występuje krzywizna pędu. Chołodnego -Wenta , opracowany na początku XX wieku, przewiduje, że w obecności asymetrycznego światła auksyna przesunie się w kierunku zacienionej strony i będzie sprzyjać wydłużaniu się komórek po tej stronie, powodując zakrzywienie rośliny w kierunku źródła światła. Auksyny aktywują pompy protonowe, obniżając pH w komórkach po ciemnej stronie rośliny. To zakwaszenie regionu ściany komórkowej aktywuje enzymy znane jako ekspansyny które rozrywają wiązania wodorowe w strukturze ściany komórkowej, czyniąc ściany komórkowe mniej sztywnymi. Ponadto zwiększona aktywność pompy protonowej prowadzi do przedostawania się większej ilości substancji rozpuszczonych do komórek roślinnych po ciemnej stronie rośliny, co zwiększa gradient osmotyczny między symplastem a apoplastem tych komórek roślinnych. Następnie woda dostaje się do komórek wzdłuż swojego gradientu osmotycznego, co prowadzi do wzrostu ciśnienia turgoru. Spadek wytrzymałości ściany komórkowej i wzrost ciśnienia turgoru powyżej progu plastyczności powoduje pęcznienie komórek, wywierając nacisk mechaniczny, który napędza ruch fototropowy.
, że białka kodowane przez drugą grupę genów, geny PIN , odgrywają główną rolę w fototropizmie. Są transporterami auksyny i uważa się, że są odpowiedzialne za polaryzację lokalizacji auksyny. W szczególności PIN3 został zidentyfikowany jako główny nośnik auksyny. Możliwe, że fototropiny otrzymują światło i hamują aktywność kinazy PINOID (PID), która następnie promuje aktywność PIN3 . Ta aktywacja PIN3 prowadzi do asymetrycznego rozmieszczenia auksyny, co następnie prowadzi do asymetrycznego wydłużenia komórek w łodydze. pin3 mutanty miały krótsze hipokotyle i korzenie niż typ dziki, a ten sam fenotyp obserwowano w roślinach hodowanych z inhibitorami wypływu auksyny. Stosując znakowanie immunologicznym złotem anty-PIN3, zaobserwowano ruch białka PIN3. PIN3 jest zwykle zlokalizowany na powierzchni hipokotylu i łodygi, ale jest również internalizowany w obecności brefeldyny A (BFA), inhibitora egzocytozy. Mechanizm ten umożliwia zmianę położenia PIN3 w odpowiedzi na bodziec środowiskowy. Uważano, że białka PIN3 i PIN7 odgrywają rolę w fototropizmie indukowanym impulsem. Odpowiedzi krzywizny w mutancie „pin3” były znacznie zmniejszone, ale tylko nieznacznie zmniejszone w mutantach „pin7”. Istnieje pewna redundancja między „PIN1”, „PIN3” i „PIN7”, ale uważa się, że PIN3 odgrywa większą rolę w fototropizmie indukowanym impulsem.
Istnieją fototropiny, które są silnie wyrażane w górnym obszarze koleoptyli. Istnieją dwa główne fototropizmy: phot1 i phot2. phot2 mają reakcje fototropowe, takie jak typ dziki, ale podwójne mutanty phot1 phot2 nie wykazują żadnych odpowiedzi fototropowych. Ilości PHOT1 i PHOT2 różnią się w zależności od wieku rośliny i intensywności światła. W dojrzałych liściach Arabidopsis występuje duża ilość PHOT2 , co zaobserwowano również w ortologach ryżu. Wyrażenie PHOT1 i PHOT2 zmieniają się w zależności od obecności światła niebieskiego lub czerwonego. Wystąpiła regulacja w dół PHOT1 w obecności światła, ale regulacja w górę transkryptu PHOT2. Poziomy mRNA i białka obecnego w roślinie były zależne od wieku rośliny. Sugeruje to, że poziomy ekspresji fototropin zmieniają się wraz z dojrzewaniem liści. Dojrzałe liście zawierają chloroplasty, które są niezbędne w fotosyntezie. Przegrupowanie chloroplastów zachodzi w różnych środowiskach świetlnych, aby zmaksymalizować fotosyntezę. Istnieje kilka genów zaangażowanych w fototropizm roślin, w tym NPH1 i gen NPL1 . Oba są zaangażowane w przegrupowanie chloroplastów. Stwierdzono, że podwójne mutanty nph1 i npl1 mają zmniejszone reakcje fototropowe. W rzeczywistości oba geny są zbędne w określaniu krzywizny łodygi.
Ostatnie badania ujawniają, że wiele kinaz AGC, z wyjątkiem PHOT1 i PHOT2, bierze udział w fototropizmie roślin. Po pierwsze, PINOID, wykazujący wzór ekspresji indukowany światłem, określa subkomórkową relokację PIN3 podczas odpowiedzi fototropowych poprzez bezpośrednią fosforylację. Po drugie, D6PK i jego homologi D6PKL modulują aktywność transportu auksyny przez PIN3, prawdopodobnie również poprzez fosforylację. Po trzecie, powyżej D6PK/D6PKL, PDK1.1 i PDK1.2 działają jako niezbędny aktywator tych kinaz AGC. Co ciekawe, różne kinazy AGC mogą uczestniczyć w różnych etapach podczas postępu odpowiedzi fototropowej. D6PK/D6PKL wykazują zdolność do fosforylacji większej liczby fosfozytów niż PINOID.
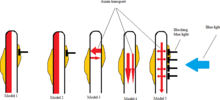
Pięć modeli dystrybucji auksyny w fototropizmie
W 2012 roku Sakai i Haga nakreślili, w jaki sposób różne stężenia auksyny mogą powstawać na zacienionej i oświetlonej stronie łodygi, wywołując reakcję fototropową. Zaproponowano pięć modeli dotyczących fototropizmu łodygi , wykorzystując Arabidopsis thaliana jako roślinę badawczą.
- Pierwszy model
W pierwszym modelu wpadające światło dezaktywuje auksynę po jasnej stronie rośliny, pozwalając zacienionej części na dalszy wzrost i ostatecznie wygięcie rośliny w kierunku światła.
- Drugi model
W drugim modelu światło hamuje biosyntezę auksyny po jasnej stronie rośliny, zmniejszając w ten sposób stężenie auksyny w stosunku do strony nienaruszonej.
- Trzeci model
W trzecim modelu występuje poziomy przepływ auksyny zarówno z jasnej, jak i ciemnej strony rośliny. Wpadające światło powoduje przepływ większej ilości auksyny z odsłoniętej strony na stronę zacienioną, zwiększając stężenie auksyny po zacienionej stronie, a tym samym większy wzrost.
- Model czwarty
W czwartym modelu pokazuje, że roślina otrzymująca światło hamuje basipetal auksyny w dół do odsłoniętej strony, powodując, że auksyna spływa tylko po zacienionej stronie.
- Model piąty
Model piąty obejmuje elementy zarówno modelu 3, jak i 4. Główny przepływ auksyny w tym modelu pochodzi ze szczytu rośliny pionowo w dół w kierunku podstawy rośliny, przy czym część auksyny przemieszcza się poziomo z głównego strumienia auksyny na obie strony rośliny. Odbieranie światła hamuje poziomy przepływ auksyny z głównego pionowego przepływu auksyny do napromieniowanej odsłoniętej strony. Według badań Sakai i Haga obserwowana asymetryczna dystrybucja auksyny i późniejsza reakcja fototropowa w hipokotylach wydają się najbardziej zgodne z tym piątym scenariuszem.
Wpływ długości fali
Fototropizm u roślin takich jak Arabidopsis thaliana jest kierowany przez receptory światła niebieskiego zwane fototropinami . Inne światłoczułe receptory w roślinach obejmują fitochromy , które wyczuwają światło czerwone i kryptochromy , które wyczuwają światło niebieskie. Różne organy rośliny mogą wykazywać różne reakcje fototropowe na różne długości fal światła. Końcówki łodyg wykazują pozytywne reakcje fototropowe na światło niebieskie, podczas gdy wierzchołki korzeni wykazują ujemne reakcje fototropowe na światło niebieskie. Zarówno wierzchołki korzeni, jak i większość wierzchołków łodyg wykazuje pozytywny fototropizm w świetle czerwonym. [ potrzebne źródło ] Kryptochromy to fotoreceptory, które pochłaniają światło niebieskie/UV-A i pomagają kontrolować rytm dobowy roślin i czas kwitnienia. Fitochromy to fotoreceptory, które wyczuwają światło czerwone/dalekoczerwone, ale pochłaniają również światło niebieskie; mogą między innymi kontrolować kwitnienie dorosłych roślin i kiełkowanie nasion. Połączenie reakcji fitochromów i kryptochromów pozwala roślinie reagować na różne rodzaje światła. Razem fitochromy i kryptochromy hamują grawitropizm w hipokotylach i przyczyniają się do fototropizmu.
Galeria
Rzeżucha Thale ( Arabidopsis thaliana ) jest regulowana przez światło niebieskie do UV
Phycomyces , grzyb, również wykazuje fototropizm
Przykład na Phalaenopsis
Przykład na fasoli Azuki
Ravenalas rosnące między dwoma budynkami w Kinszasie w Demokratycznej Republice Konga . Płaszczyzna (tutaj prostopadła do osi północ-południe) tych dwóch roślin jest zorientowana tak, aby zmaksymalizować absorpcję światła dziennego
Zobacz też
Bibliografia
- Silny, Donald R.; Ray, Thomas S. (1 stycznia 1975). „Zachowanie lokalizacji drzewa gospodarza tropikalnej winorośli ( Monstera gigantea ) przez skototropizm” . nauka . 190 (4216): 804–806. Bibcode : 1975Sci...190..804S . doi : 10.1126/science.190.4216.804 . JSTOR 1741614 . S2CID 84386403 .
Linki zewnętrzne
-
 Media związane z fototropizmem w Wikimedia Commons
Media związane z fototropizmem w Wikimedia Commons - Filmy poklatkowe , Rośliny w ruchu