Hydroacylowanie
Hydroacylowanie jest rodzajem reakcji organicznej , w której alken jest wstawiany w wiązanie formylowe CH. Produkt jest ketonem . Reakcja wymaga katalizatora metalicznego . Jest to prawie niezmiennie praktykowane jako reakcja wewnątrzcząsteczkowa przy użyciu homogenicznych katalizatorów , często na bazie fosfin rodu.
- RCHO + CH 2 = CHR' → RC(O)CH 2 CH 2 R'
Z alkinem zamiast alkenów reakcja daje α,β-nienasycony keton .
Przykłady
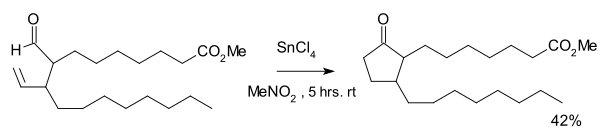
Reakcja została odkryta jako część drogi syntezy niektórych prostanoidów . Reakcja wymagała czterochlorku cyny i stechiometrycznej ilości katalizatora Wilkinsona . W wyniku dekarbonylacji powstała taka sama ilość cyklopropanu .
Pierwsze zastosowanie katalityczne obejmowało cyklizację 4-pentenalu do cyklopentanonu przy użyciu katalizatora Wilkinsona . W tej reakcji rozpuszczalnik był nasycony etylenem .
- CH 2 = CHCH 2 CH 2 CHO → (CH 2 ) 4 CO
Mechanizm reakcji
Badania znakowania ustalają następującą regiochemię:
- RCDO + CH 2 =CHR' → RC(O)CH 2 CHDR'
Jeśli chodzi o mechanizm reakcji , hydroacylowanie rozpoczyna się od utleniającej addycji wiązania aldehydowego węgiel-wodór . Powstały kompleks wodorku acylu następnie wiąże alken. Sekwencja addycji oksydacyjnej i koordynacji alkenów jest często niejasna. Poprzez insercję migracyjną alken wstawia się w wiązania metal-acyl lub metal-wodorek. W końcowym etapie powstały kompleks alkilo-acylowy lub beta-ketoalkilowo-wodorkowy podlega redukcyjnej eliminacji . Konkurencyjną reakcją uboczną jest dekarbonylacja aldehydu. Proces ten przebiega również za pośrednictwem wodorku acylu metalu :
- R"C(O)-ML n -H → R"-M(CO)L n -H
Po tym etapie można przeprowadzić redukcyjną eliminację alkanu:
Asymetryczne hydroacylowanie
Hydroacylację jako reakcję asymetryczną wykazano w postaci rozdziału kinetycznego. Opisano również prawdziwą syntezę asymetryczną. W obu konwersjach zastosowano rodowe i chiralny ligand difosfinowy . W jednym zastosowaniu ligandem jest Me-DuPhos :