Jon fosforowy
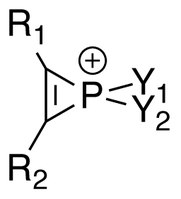
Jony fosforu ( R
1 R
2 C
2 PY
1 Y
+ 2 ) to szereg związków fosforoorganicznych zawierających nienasycone trójczłonowe pierścienie heterocykliczne fosforu (V) i uważa się, że σ*-aromatyczność jest obecna w takich cząsteczkach. Wiele soli zawierających jony fosfirenowe zostało wyizolowanych i scharakteryzowanych za pomocą spektroskopii NMR i krystalografii rentgenowskiej .
Synteza
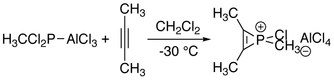
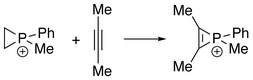
Pierwsza seria jonów fosfirenowych została zsyntetyzowana w reakcji alkinów z dichlorkiem metylo- lub fenylofosfonowym i trichlorkiem glinu. Reakcje te można uznać za formalne dodanie „RClP + ” do alkinów.
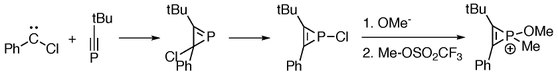
Reakcje [2+1]-cykloaddycji między fosfaalkinami i chlorokarbenem dają fosfireny, które służą jako materiały wyjściowe do wytwarzania związków fosforu.
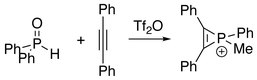
Traktowanie tlenku difenylofosfiny difenyloacetylenem daje formy fosforynu.
Jony fosforu można również otrzymać w reakcji między fosfiranami i alkinami, gdzie „RClP + ” jest formalnie przeniesiony z alkenów na alkiny.
Charakteryzacje
W literaturze widma 31 P NMR jonów fosforu wykazują przesunięcia w górę pola (-57,3 ppm, gdy R1 = R2 = Y1 = CH3 , Y2 = Cl). W 1H NMR stwierdza się również duże stałe sprzęgania J i są one porównywalne z tymi występującymi w jonach cyklopropenium .
Pierwszy jon fosforynu scharakteryzowany za pomocą krystalografii rentgenowskiej ma następujący wzór strukturalny:
Stwierdzono, że w wyrafinowanej strukturze krystalicznej średnia odległość między fosforem a cyklicznym węglem wynosi 1,731 (12) Å, co w przybliżeniu odpowiada rządowi wiązań 1,5. Dla porównania, typowe odległości P-C z pojedynczym i podwójnym wiązaniem wynoszą odpowiednio 1,86 Å i 1,68 Å.
Reaktywność
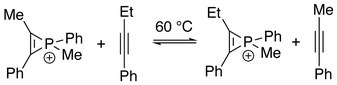
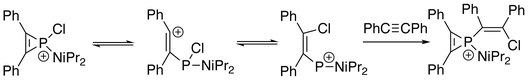
Przypominając wymianę π-liganda w związkach koordynacyjnych , jon fosfirenowy może ulegać wymianie alkinowej z innymi alkinami, dając mieszaninę gatunków fosfirenowych w równowadze. Kinetycznie sugeruje się, że eliminacja alkinu z kationu jest etapem determinującym szybkość .
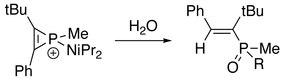
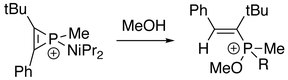
Ponadto trójczłonowy pierścień jonu fosforowego może zostać zerwany. Na elektrofilowym atomie fosforu mogą zachodzić kolejne reakcje z odpowiednim nukleofilem. W obecności alkinu:
W obecności wody lub alkoholu:
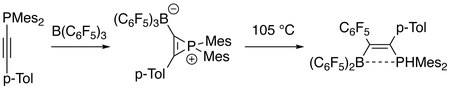
Elektrofilowy B(C 6 F 5 ) 3 łatwo reaguje z fosfinyloalkinami w temperaturze pokojowej, dając jako półprodukty boranowo-fosfirenowe jony obojnacze, które następnie wytwarzają produkty aktywacji wiązania węgiel-fosfor σ w wyższej temperaturze. Produkty są przedmiotem zainteresowania materiałoznawstwa. Linia kropkowana w produkcie wskazuje na słabe oddziaływanie między atomami boru i fosforu (patrz sfrustrowana para Lewisa ).
σ*-aromatyczność
Jakościowy diagram orbitali molekularnych (MO) jonu fopirenu można uzyskać przez liniową kombinację orbitali z fragmentu PY
+ 2 i wygiętego fragmentu RC=CR. Nisko położony orbital σ* z pierwszego z symetrią ungerade oddziałuje zarówno z orbitalem π, jak i π* drugiego, tworząc system 2π-Hückel , analogiczny do tego w jonie cyklopropenium. Efekt ten został nazwany σ*-aromatycznością. Warto zauważyć, że w przeciwieństwie do jonu cyklopropenium, oddziaływanie między wypełnionym orbitalem σ PY
+ 2 fragment i orbitale π również prowadzą do pewnego stopnia charakteru antyaromatycznego. Dlatego 3-centralny efekt koniugacyjny netto jest połączeniem zarówno wkładu stabilizującego σ*, jak i wkładu destabilizującego σ.
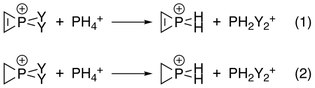
Elektroujemność każdego podstawnika na fosforze odgrywa rolę, ponieważ te, które dostarczają więcej elektronów, dają większy stopień destabilizacji antyaromatycznej sigma. Zostało to potwierdzone przez Natural Population Analysis (NPA), w której zmiany energii poniższych reakcji zostały obliczone z interakcjami między podwójnym wiązaniem C – C i fosforem zarówno włączanymi, jak i wyłączanymi poprzez manipulowanie elementami matrycy Focka :
Energie destabilizacji były różnicami między odpowiednimi reakcjami:
- Energia destabilizacji = energia (1) − energia (2)
- Energia destabilizacji z różnymi grupami Y: Y = F > OH > Cl > NH 2 > Br > I > CH 3 > H
Ta seria jest zgodna z trendem elektroujemności atomów liganda.
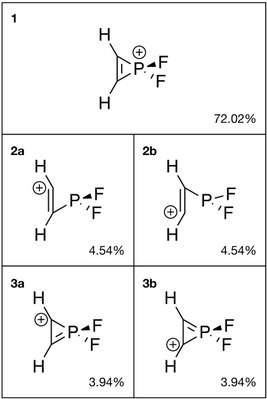
orbitali wiązań naturalnych (NBO) dostarcza możliwych struktur Lewisa cząsteczki i została przeprowadzona w celu oceny struktury H
2 C
2 PF
+ 2 . Podobnie jak aromatyczny jon cyklopropenium, analog fosforu wykazuje rezonans między strukturą z podwójnym wiązaniem węgiel-węgiel ( 1 , 72,02%) a strukturami z podwójnym wiązaniem węgiel-fosfor ( 3a i 3b , łącznie 7,88%). Ponadto, otwarcie pierścienia tworzy 2a i 2b razem zajmują również 9,08% masy.