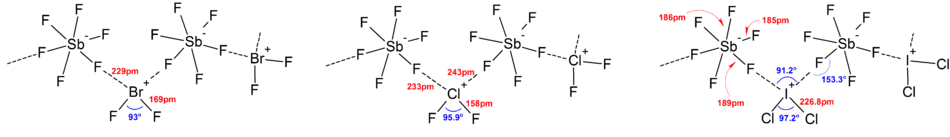Jony polihalogenowe
Jony polihalogenowe to grupa wieloatomowych kationów i anionów zawierających wyłącznie halogeny . Jony można podzielić na dwie klasy: jony izopolihalogenowe, które zawierają tylko jeden rodzaj halogenu, oraz jony heteropolihalogenowe zawierające więcej niż jeden rodzaj halogenu.
Wstęp
Znaleziono liczne jony polihalogenowe, których sole wyizolowano w stanie stałym i scharakteryzowano strukturalnie. Poniższe tabele podsumowują znane gatunki.
| Gatunki dwuatomowe | * [Cl 2 ] + , [Br 2 ] + , [I 2 ] + |
| Gatunki trójatomowe | [Cl 3 ] + , [Br 3 ] + , [I 3 ] + |
| Gatunki tetraatomowe | [Cl4 ] + , [ I4 ] 2+ |
| Gatunki pentaatomowe | [Br 5 ] + , [I 5 ] + |
| Gatunki heptaatomowe | † [I 7 ] + |
| Wyższe gatunki | [I 15 ] 3+ |
* [Cl 2 ] + może istnieć tylko jako [Cl 2 O 2 ] 2+ w niskich temperaturach, kompleks z przeniesieniem ładunku od O 2 do [Cl 2 ] + . Wolny [Cl 2 ] + jest znany jedynie z widma pasma elektronowego uzyskanego w niskociśnieniowej rurze wyładowczej.
† Istnienie [I 7 ] + jest możliwe, ale nadal niepewne.
| Gatunki trójatomowe | [ClF 2 ] + , [Cl 2F ] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [IBrCl] + , [IBr 2 ] + , [I 2Cl ] + , [ I 2 Br] + |
| Gatunki pentaatomowe | [ClF 4 ] + , [BrF 4 ] + , [IF 4 ] + , [I 3Cl 2 ] + |
| Gatunki heptaatomowe | [ClF6 ] + , [BrF6 ] + , [ IF6 ] + |
| Gatunki trójatomowe | [Cl 3 ] - , [Br 3 ] - , [I 3 ] - |
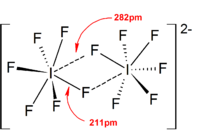
| Gatunki tetraatomowe | [Br 4 ] 2− , [I 4 ] 2− |
| Gatunki pentaatomowe | [Ja 5 ] − |
| Gatunki heptaatomowe | [Ja 7 ] − |
| Gatunki ośmioatomowe | [Br 8 ] 2− , [I 8 ] 2− |
| Wyższe gatunki | [I 9 ] − , [I 10 ] 2− , [I 10 ] 4− , [I 11 ] − , [I 12 ] 2− , [I 13 ] 3− , [I 16 ] 2− , [I 22 ] 4− , [I 26 ] 3− , [I 26 ] 4− , [I 28 ] 4− , [I 29 ] 3− |
| Gatunki trójatomowe | [ClF 2 ] − , [BrF 2 ] − , [BrCl 2 ] − , [IF 2 ] − , [ICl 2 ] − , [IBrF] − , [IBrCl] − , [IBr 2 ] − , [I 2 Cl ] − , [I 2Br ] − , [AtBrCl] − , [AtBr 2 ] − , [AtICl] − , [AtIBr] − , [AtI 2 ] − |
| Gatunki pentaatomowe | [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 3 F] - , [ICl 4 ] - , [IBrCl 3 ] - , [I 2 Cl 3 ] - , [I 2 BrCl 2 ] - , [I 2 Br 2 Cl] - , [I 2 Br 3 ] - , [Ja 4Cl ] - , [I 4Br ] - |
| Gatunek heksaatomowy | [JEŻELI 5 ] 2− |
| Gatunki heptaatomowe | [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - , [I 3 Br 4 ] - |
| Gatunki nieatomowe | [JEŚLI 8 ] − |
Struktura
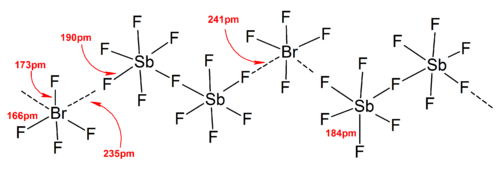
Większość struktur jonów została określona za pomocą spektroskopii IR , spektroskopii Ramana i krystalografii rentgenowskiej . Jony polihalogenowe zawsze zawierają najcięższy i najmniej elektroujemny halogen obecny w jonie jako atom centralny, co w niektórych przypadkach powoduje, że jon jest asymetryczny. Na przykład [Cl 2 F] + ma strukturę [Cl-Cl-F] - ale nie [Cl-F-Cl] - .
Ogólnie struktury większości jonów heteropolihalogenowych i niższych jonów izopolihalogenowych były zgodne z modelem VSEPR . Zdarzały się jednak wyjątkowe przypadki. Na przykład, gdy atom centralny jest ciężki i ma siedem samotnych par , takich jak [BrF 6 ] - i [IF 6 ] - , mają one regularny oktaedryczny układ ligandów fluorkowych zamiast zniekształconego ze względu na obecność stereochemicznego układu bezwładna samotna para . W strukturach ciała stałego stwierdzono więcej odchyleń od idealnego modelu VSEPR ze względu na silne oddziaływania kation-anion, co również komplikuje interpretację spektroskopii wibracyjnej . We wszystkich znanych strukturach soli anionów polihalogenowych, aniony mają bardzo bliski kontakt, poprzez mostki halogenowe, z przeciwkationami. Na przykład w stanie stałym [IF 6 ] − nie jest regularnie oktaedryczny, ponieważ struktura ciała stałego [(CH 3 ) 4 N] + [IF 6 ] − ujawnia luźno związane [I 2 F 11 ] 2- dimery. Istotne oddziaływania kation-anion stwierdzono także w [BrF 2 ] + [SbF 6 ] - , [ClF 2 ] + [SbF 6 ] - , [BrF 4 ] + [Sb 6 F 11 ] - .
| Liniowy (lub prawie liniowy) | [ClF 2 ] − , [BrF 2 ] − , [BrCl 2 ] − , [IF 2 ] − , [ICl 2 ] − , [IBr 2 ] − , [I 2 Cl] − , [I 2 Br] − |
| Zgięty | [ClF 2 ] + , [Cl 2F ] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [I 2Cl ] + , [IBr 2 ] + , [I 2 Br] + , [IBrCl] + |
| Kwadratowy planarny | [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 4 ] - |
| Dysfenoidalny (lub huśtawka) | [ClF4 ] + , [BrF4 ] + , [ IF4 ] + |
| Płaska pięciokątna | ‡ [JEŻELI 5 ] 2− |
| Ośmiościan | [ClF 6 ] + , [BrF 6 ] + , [IF 6 ] + , ¶ [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - |
| Kwadratowy antypryzmatyczny | [JEŚLI 8 ] − |
‡ [IF 5 ] 2− jest jednym z dwóch gatunków typu XY n , o których wiadomo, że mają rzadką pięciokątną geometrię planarną, drugim jest [XeF 5 ] − .
¶ [ClF 6 ] - jest zniekształcony oktaedrycznie, ponieważ efekt stereochemicznej pary obojętnej nie jest znaczący w atomie chloru.
Jony [I 3Cl 2 ] + , i [I 3 Br 2 ] + mają strukturę typu trans - Z analogiczną do struktury [I 5 ] + .
Wyższe polijodki
polijodkowe mają znacznie bardziej skomplikowaną strukturę . Dyskretne polijodki mają zwykle liniową sekwencję atomów jodu i jonów jodkowych i są opisywane w kategoriach powiązania między jednostkami I 2 , I - i [I 3 ] - , co odzwierciedla pochodzenie polijodku. W stanie stałym polijodki mogą oddziaływać ze sobą, tworząc łańcuchy, pierścienie, a nawet skomplikowane sieci dwu- i trójwymiarowe.
Klejenie
Wiązanie w jonach polihalogenowych najczęściej opiera się na zastosowaniu orbitali p. Znaczący udział orbity d w wiązaniu jest mało prawdopodobny, ponieważ wymagana będzie duża ilość energii promocyjnej, podczas gdy w przypadku gatunków zawierających jod oczekuje się niewielkiego udziału orbity s ze względu na efekt pary obojętnej, sugerowany przez dane ze spektroskopii Mössbauera . Jednakże żaden model wiązania nie był w stanie odtworzyć tak szerokiego zakresu obserwowanych dotychczas długości i kątów wiązań.
Jak można się spodziewać na podstawie faktu, że elektron jest usuwany z orbitalu antywiązania , gdy X 2 jest zjonizowany do [X 2 ] + , porządek wiązań , jak również siła wiązania w [X 2 ] + stają się wyższe, w konsekwencji odległości międzyatomowe w jon X2 molekularny jest mniejszy niż w .
Liniowe lub prawie liniowe trójatomowe polihalogenki mają słabsze i dłuższe wiązania w porównaniu z odpowiednimi dwuatomowymi międzyhalogenami lub halogenami, co jest zgodne z dodatkowym odpychaniem między atomami, gdy jon halogenkowy jest dodawany do cząsteczki obojętnej. Istnieje inny model wykorzystujący teorię rezonansu , np. [ICl 2 ] – można go postrzegać jako hybrydę rezonansową następujących form kanonicznych :
Dowody potwierdzające tę teorię pochodzą z długości wiązań (255 µm w [ICl 2 ] – i 232 µm w ICl (g)) oraz liczb falowych rozciągania wiązania (267 i 222 cm –1 dla symetrycznego i asymetrycznego rozciągania w [ICl 2 ] – porównane z 384 cm -1 w ICl), co sugeruje rząd wiązań około 0,5 dla każdego wiązania I-Cl w [ICl 2 ] - , zgodnie z interpretacją wykorzystującą teorię rezonansu. Inne gatunki trójatomowe [XY 2 ] − można interpretować podobnie.
Mimo że mają zmniejszoną kolejność wiązań, wszystkie trzy atomy halogenu są ściśle związane. Wiązanie fluor-fluor w trifluorku, o rzędzie wiązań 0,5, ma siłę wiązania wynoszącą 30 kcal/mol, tylko o 8 kcal/mol mniej niż wiązanie fluor-fluor w difluorze, którego rząd wiązań wynosi 1 .
Synteza
Tworzenie jonów polihalogenowych można postrzegać jako samodysocjację ich macierzystych międzyhalogenów lub halogenów :
- 2 XY n ⇌ [XY n −1 ] + + [XY n +1 ] −
- 3 X 2 ⇌ [X 3 ] + + [X 3 ] −
- 4 X 2 ⇌ [X 5 ] + + [X 3 ] −
- 5 X 2 ⇌ 2 [X 2 ] + + 2 [X 3 ] −
Kationy polihalogenowe
Istnieją dwie ogólne strategie wytwarzania kationów polihalogenowych:
- Poprzez reakcję odpowiedniego międzyhalogenu z kwasem Lewisa (takim jak halogenki B , Al , P , As , Sb ) w obojętnym lub utleniającym rozpuszczalniku (takim jak bezwodny HF ) lub bez niego, z wytworzeniem kationu heteropolihalogenowego.
- XY n + MY m → [XY n -1 ] + + [MY m +1 ] -
- W procesie utleniania, w którym halogen lub międzyhalogen poddaje się reakcji z utleniaczem i kwasem Lewisa, otrzymując kation:
- Cl 2 + ClF + AsF 5 → [Cl 3 ] + [AsF 6 ] -
W niektórych przypadkach sam kwas Lewisa ( akceptor fluoru ) działa jako utleniacz:
- 3 Ja 2 + 3 SbF 5 → 2 [Ja 3 ] + [SbF 6 ] − + SbF 3
Zwykle do wytwarzania kationów heteropolihalogenowych stosuje się pierwszą metodę, a drugą do obu. Proces utleniania jest przydatny do wytwarzania kationów [IBr 2 ] + , [ClF 6 ] + , [BrF 6 ] + , ponieważ ich macierzyste międzyhalogeny, odpowiednio IBr 3 , ClF 7 , BrF 7 , nigdy nie zostały wyizolowane:
- Br 2 + IOSO 2 F → [IBr 2 ] + [SO 3 F] −
- 2 ClF 5 + 2 PtF 6 → [ClF 6 ] + [PtF 6 ] − + [ClF 4 ] + [PtF 6 ] −
- BrF 5 + [KrF] + [AsF 6 ] − → [BrF 6 ] + [AsF 6 ] − + Kr
Przygotowanie niektórych poszczególnych gatunków podsumowano w skrócie w poniższej tabeli za pomocą równań:
| Gatunek | Odpowiednie równanie chemiczne | Wymagane dodatkowe warunki |
|---|---|---|
| [Cl 2 ] + (jako [Cl 2 O 2 ] + ) | Cl 2 + [O 2 ] + [SbF 6 ] − → [Cl 2 O 2 ] + [SbF 6 ] − | w bezwodnym HF w niskich temperaturach |
| [Br 2 ] + | Br 2 (w BrSO 3 F) + 3 SbF 5 → [Br 2 ] + [Sb 3 F 16 ] − (niezrównoważony) | w temperaturze pokojowej |
| [Ja 2 ] + | 2 ja 2 + S 2 O 6 fa 2 → 2 [Ja 2 ] + [SO 3 fa] − | w HSO3F _ _ |
| [ Cl3 ] + | Cl 2 + ClF + AsF 5 → [Cl 3 ] + [AsF 6 ] − | w temperaturze 195 K (-78°C) |
| [Br 3 ] + | 3 Br 2 + 2 [O 2 ] + [AsF 6 ] − → 2 [Br 3 ] + [AsF 6 ] − + 2 O 2 | |
| [Ja 3 ] + | 3 ja 2 + S 2 O 6 fa 2 → 2 [Ja 3 ] + [SO 3 fa] − | |
| [ Cl4 ] + | 2 Cl 2 + IrF 6 → [Cl 4 ] + [IrF 6 ] − | w bezwodnym HF, w temperaturze poniżej 193 K (-80°C) |
| [Ja 4 ] 2+ | 2 Ja 2 + 3 AsF 5 → [Ja 4 ] 2+ [AsF 6 ] - 2 + AsF 3 | SO2 w ciekłym |
| [Br 5 ] + | 8 Br 2 + 3 [XeF] + [AsF 6 ] − → 3 [Br 5 ] + [AsF 6 ] − + 3 Xe + BrF 3 | |
| [Ja 5 ] + | 2 Ja 2 + ICl + AlCl 3 → [I 5 ] + [AlCl 4 ] − | |
| [Ja 7 ] + | 7 Ja 2 + S 2 O 6 F 2 → 2 Ja 7 SO 3 F | |
| [ ClF2 ] + | ClF 3 + AsF 5 → [ClF 2 ] + [AsF 6 ] − | |
| [ Cl2F ] + | 2ClF + AsF5 → [ Cl2F ] + [ AsF6 ] − | w temperaturze poniżej 197 K |
| [ BrF2 ] + | 5 BrF 3 + 2 Au → 3 BrF + 2 [BrF 2 ] + [AuF 4 ] − | wymaganym nadmiarem BrF 3 |
| [JEŚLI 2 ] + | JEŻELI 3 + AsF 5 → [IF 2 ] + [AsF 6 ] − | |
| [ IC12 ] + | ICl 3 + SbCl 5 → [ICl 2 ] + [SbCl 6 ] − | |
| [ IBr2 ] + | Br2 + IOSO2F → [ IBr2 ] + [ SO3F ] − | |
| [ ClF4 ] + | ClF 5 + SbF 5 → [ClF 4 ] + [SbF 6 ] − | |
| [ BrF4 ] + | BrF 5 + AsF 5 → [BrF 4 ] + [AsF 6 ] − | |
| [JEŚLI 4 ] + | JEŻELI 5 + 2 SbF 5 → [JEŻELI 4 ] + [Sb 2 F 11 ] − | |
| [ ClF6 ] + | ‡ Cs 2 [NiF 6 ] + 5 AsF 5 + ClF 5 → [ClF 6 ] + [AsF 6 ] − + Ni[AsF 6 ] 2 + 2 Cs[AsF 6 ] | |
| [ BrF6 ] + | [KrF] + [AsF 6 ] − + BrF 5 → [BrF 6 ] + [AsF 6 ] − + Kr | |
| [JEŚLI 6 ] + | JEŻELI 7 + BrF 3 → [IF 6 ] + [BrF 4 ] − |
‡ W tej Cs2 [NiF6 ] / reakcji aktywną formą utleniającą jest / [ NiF3 ] + , który tworzy się in situ w układzie AsF5 HF. Jest jeszcze silniejszym środkiem utleniającym i fluorującym niż PtF6 .
Aniony polihalogenowe
W przypadku anionów polihalogenowych istnieją również dwie ogólne strategie przygotowania:
- Reagując międzyhalogen lub halogen z zasadą Lewisa , najprawdopodobniej fluorkiem:
- [(CH 3 CH 2 ) 4 N] + Y - + XY n → [(CH 3 CH 2 ) 4 N] + [XY n +1 ] −
- X 2 + X − → [X 3 ] −
- Przez utlenianie prostych halogenków :
- KI + Cl 2 → K + [ICl 2 ] −
Przygotowanie niektórych poszczególnych gatunków podsumowano w skrócie w poniższej tabeli za pomocą równań:
| Gatunek | Odpowiednie równanie chemiczne | Wymagane dodatkowe warunki |
|---|---|---|
| [Cl 3 ] - , [Br 3 ] - , [I 3 ] - | X 2 + X − → [X 3 ] − (X = Cl, Br, I) | |
| [Br 3 ] − | Br 2 + [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + Br - → [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + [Br 3 ] - | w 1,2-dichloroetanie lub ciekłym ditlenku siarki . [Br 3 ] − nie występuje w roztworze i powstaje dopiero podczas krystalizacji soli. |
| [Br 5 ] − | 2 Br 2 + [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + Br - → [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + [Br 5 ] - | w 1,2-dichloroetanie lub ciekłym ditlenku siarki, z nadmiarem Br2 |
| [ ClF2 ] - | ClF + CsF → Cs + [ClF 2 ] − | |
| [ BrCl2 ] - | Br 2 + Cl 2 + 2 CsCl → 2 Cs + [BrCl 2 ] − | |
| [ ICl2 ] - | KI + Cl2 → K + [ ICl2 ] − | |
| [ IBr2 ] − | CsI + Br 2 → Cs + [IBr 2 ] − | |
| [AtBr 2 ] − , [AtICl] − , [AtIBr] − , [AtI 2 ] − | Przy Y + X − → [AtXY] − (X = I, Br, Cl; Y = I, Br) | |
| [ ClF4 ] - | NOF + ClF3 → [NO] + [ ClF4 ] − | |
| [ BrF4 ] - | 6 KCl + 8 BrF 3 → 6 K + [BrF 4 ] - + 3 Cl 2 + Br 2 | potrzebny nadmiar BrF5 _ |
| [JEŚLI 4 ] − | 2 XeF 2 + [(CH 3 ) 4 N] + ja − → [(CH 3 ) 4 N] + [JEŻELI 4 ] − + 2 Xe | reagenty zmieszano w temperaturze 242 K, następnie ogrzano do 298 K, aby reakcja mogła zachodzić |
| [ ICl4 ] - | KI + ICl 3 → K + [ICl 4 ] − | |
| [JEŻELI 5 ] 2− | JEŚLI 3 + 2 [(CH 3 ) 4 N] + fa − → [(CH 3 ) 4 N + ] 2 [JEŻELI 5 ] 2− | |
| [JEŻELI 6 ] − | JEŻELI 5 + CsF → Cs + [JEŻELI 6 ] − | |
| [I 3 Br 4 ] − | Ph 4 P] + Br - + 3 IBr → [Ph 4 P] + [I 3 Br 4 ] - | |
| [JEŚLI 8 ] − | JEŚLI 7 + [(CH 3 ) 4 N] + fa – → [(CH 3 ) 4 N] + [JEŻELI 8 ] – | w acetonitrylu |
Wyższe polijodki powstały w wyniku krystalizacji roztworów zawierających różne stężenia I - i I 2 . Na przykład monohydrat K + [I 3 ] - krystalizuje po ochłodzeniu nasyconego roztworu zawierającego odpowiednie ilości I 2 i KI .
Nieruchomości
Stabilność
Ogólnie rzecz biorąc, duży przeciwkation lub anion (taki jak Cs + i [SbF6 ] - ) może pomóc w stabilizacji jonów polihalogenowych utworzonych w stanie stałym ze względów energetycznych sieci , w miarę wzrostu wydajności upakowania.
Kationy polihalogenowe są silnymi utleniaczami, na co wskazuje fakt, że można je wytwarzać wyłącznie w cieczach utleniających jako rozpuszczalnik, takich jak oleum . Najbardziej utleniające i dlatego najbardziej niestabilne są gatunki [X 2 ] + i [XF 6 ] + (X = Cl, Br), a następnie [X 3 ] + i [IF 6 ] + .
Stabilność soli [X2 ] + ( X = Br, I) jest termodynamicznie dość stabilna. Jednakże ich stabilność w roztworze zależy od superkwasowego . Na przykład [I 2 ] + jest trwały w kwasie fluoroantymonowym (HF z 0,2 N SbF 5 , H 0 = -20,65), ale jest nieproporcjonalny do [I 3 ] + , [I 5 ] + i I 2 zamiast SbF5 dodaje się NbF5 słabsze jak akceptory fluoru, TaF5 takie , lub NaF .
- 14 [Ja 2 ] + + 5 fa − → 9 [Ja 3 ] + + JEŻELI 5
W przypadku anionów polihalogenowych z tym samym kationem, bardziej stabilne są te z cięższym halogenem w środku, jony symetryczne są również bardziej stabilne niż asymetryczne. dlatego stabilność anionów maleje w kolejności:
- [I 3 ] − > [IBr 2 ] − > [ICl 2 ] − > [I 2 Br] − > [Br 3 ] − > [BrCl 2 ] − > [Br 2Cl ] −
Jony heteropolihalogenowe o liczbie koordynacyjnej większej lub równej cztery mogą istnieć tylko z ligandami fluorkowymi.
Kolor
Większość jonów polihalogenowych jest intensywnie zabarwiona, a kolor pogłębia się wraz ze wzrostem masy atomowej pierwiastka składowego. Dobrze znany skrobia -jod ma ciemnoniebieski kolor ze względu na obecność liniowych jonów [I 5 ] - w helisie amylozy . Poniżej wymieniono niektóre kolory pospolitych gatunków:
- fluorokationy są zwykle bezbarwne lub bladożółte, inne jony heteropolihalogenowe są pomarańczowe, czerwone lub ciemnofioletowe
- związki [ICl2 ] + są od wina czerwonego do jasnopomarańczowego; podczas gdy [ I2Cl ] + są ciemnobrązowe do fioletowo-czarnych
- [Cl3 ] + jest żółty
- [Cl4 ] + jest niebieski
- [Br 2 ] + jest wiśniowo-czerwony
- [Br 3 ] + jest brązowy
- [Br 5 ] + jest ciemnobrązowy
- [I 2 ] + jest jasnoniebieski
- [I 3 ] + jest ciemnobrązowy do czarnego
- [I 4 ] 2+ jest czerwone do brązowego
- [I 5 ] + jest zielony lub czarny, sól [I 5 ] + [AlCl 4 ] − występuje w postaci zielonkawo-czarnych igieł, ale w cienkich przekrojach pojawia się brązowo-czerwona
- [I 7 ] + jest czarny, jeśli jego istnienie w związku [I 7 ] + [SO 3 F] − zostało jednoznacznie ustalone
- [I 15 ] 3+ jest czarne
- [ICl 2 ] – jest szkarłatno-czerwony
- [ICl 4 ] − jest złotożółty
- polijodki mają bardzo ciemne kolory, ciemnobrązowy lub ciemnoniebieski
Właściwości chemiczne
Kationy heteropolihalogenowe są utleniaczami reaktywnymi wybuchowo, a kationy często mają wyższą reaktywność niż ich macierzyste międzyhalogeny i rozkładają się drogami redukcyjnymi. Jak można się spodziewać po najwyższym stopniu utlenienia +7 w [ClF 6 ] + , [BrF 6 ] + i [IF 6 ] + , związki te są niezwykle silnymi utleniaczami, co wykazano w reakcjach pokazanych poniżej:
- 2 O 2 + 2 [BrF 6 ] + [AsF 6 ] − → 2 [O 2 ] + [AsF 6 ] − + 2 BrF 5 + F 2
- Rn + [IF 6 ] + [SbF 6 ] − → [RnF] + [SbF 6 ] − + JEŻELI 5
Kationy polihalogenowe o niższych stopniach utlenienia mają tendencję do nieproporcjonalności . Na przykład [Cl 2 F] + jest niestabilny w roztworze i całkowicie nieproporcjonalny w mieszaninie HF/ SbF 5 nawet w temperaturze 197 K:
- 2 [Cl2F ] + → [ClF2 ] + + [ Cl3 ] +
[I 2 ] + odwracalnie dimeryzuje w temperaturze 193 K i jest obserwowane jako niebieska barwa paramagnetyku [ I 2 ] + dramatycznie zmienia się w czerwono-brązową barwę diamagnetyku [I 2 ] + , wraz ze spadkiem podatności paramagnetycznej i elektrycznej przewodnictwo po schłodzeniu roztworu do temperatury poniżej 193 K:
- 2 [Ja 2 ] + ⇌ [Ja 4 ] 2+
Dimeryzację można przypisać nakładaniu się w połowie wypełnionych orbitali π* w dwóch [I 2 ] + .
[Cl 4 ] + in [Cl 4 ] + [IrF 6 ] - jest strukturalnie analogiczny do [I 4 ] 2+ , ale rozkłada się w 195 K dając Cl 2 i sole [Cl 3 ] + zamiast [Cl 2 ] + .
Próby przygotowania ClF 7 i BrF 7 poprzez fluorowanie [ClF 6 ] + i [BrF 6 ] + przy użyciu NOF zakończyły się niepowodzeniem, ponieważ zaszły następujące reakcje:
- [ClF 6 ] + [PtF 6 ] − + NOF → [NO] + [PtF 6 ] − + ClF 5 + F 2
- [BrF 6 ] + [AsF 6 ] − + 2 NOF → [NO] + [AsF 6 ] − + [NIE] + [BrF 6 ] − + F 2
Aniony są mniej reaktywne w porównaniu do kationów i są na ogół słabszymi utleniaczami niż ich macierzyste międzyhalogeny. Są mniej reaktywne w stosunku do związków organicznych, a niektóre sole mają dość wysoką stabilność termiczną. Sole zawierające aniony polihalogenowe typu M + [X m Y n Z p ] - , gdzie m + n + p = {3, 5, 7, 9...}, mają tendencję do dysocjowania na proste sole monohalogenkowe pomiędzy M + i najbardziej elektroujemny halogen, tak że monohalogenek ma najwyższą energię sieci. Jako drugi produkt zwykle tworzy się międzyhalogen. Sól [(CH 3 ) 4 N] + [ClF 4 ] - rozkłada się w temperaturze około 100 °C, a sole [ClF 6 ] - są niestabilne termicznie i mogą eksplodować nawet w temperaturze -31 °C.