Miareczkowanie termometryczne
Miareczkowanie termometryczne jest jedną z wielu instrumentalnych technik miareczkowania , w których punkty końcowe można dokładnie i precyzyjnie zlokalizować bez subiektywnej interpretacji ze strony analityka co do ich lokalizacji. Zmiana entalpii jest prawdopodobnie najbardziej podstawową i uniwersalną właściwością reakcji chemicznych, a więc obserwacją temperatury zmiana jest naturalnym wyborem w monitorowaniu ich postępów. Nie jest to nowa technika, prawdopodobnie pierwsza rozpoznawalna metoda miareczkowania termometrycznego została opisana na początku XX wieku (Bell i Cowell, 1913). Pomimo jego atrakcyjnych funkcji i pomimo znacznych badań przeprowadzonych w tej dziedzinie i dużej liczby opracowanych aplikacji; do tej pory była to technika niedostatecznie wykorzystywana w krytycznym obszarze procesów przemysłowych i kontroli jakości. Zautomatyzowany potencjometryczny Systemy miareczkowania dominowały w tej dziedzinie od lat 70-tych. Wraz z pojawieniem się tanich komputerów zdolnych do obsługi wydajnego oprogramowania do miareczkowania termometrycznego, prace rozwojowe osiągnęły etap, w którym łatwe w użyciu zautomatyzowane systemy miareczkowania termometrycznego mogą w wielu przypadkach stanowić doskonałą alternatywę dla miareczkowania potencjometrycznego.
Porównanie miareczkowania potencjometrycznego i termometrycznego
Miareczkowanie potencjometryczne jest dominującą techniką automatycznego miareczkowania od lat 70. XX wieku, dlatego warto rozważyć podstawowe różnice między nim a miareczkowaniem termometrycznym.
Miareczkowanie wykrywane potencjometrycznie opiera się na swobodnej zmianie energii w układzie reakcyjnym. Konieczny jest pomiar składnika zależnego od energii swobodnej.
- 0 Δ G = - RT ln K (1)
Gdzie:
- 0 ΔG = zmiana energii swobodnej
- R = uniwersalna stała gazowa
- T = temperatura w kelwinach (K) lub stopniach Rankine'a (°R)
- K = stała równowagi w temperaturze T
- ln jest funkcją logarytmu naturalnego
Aby reakcja była podatna na miareczkowanie potencjometryczne, zmiana energii swobodnej musi być wystarczająca, aby odpowiedni czujnik zareagował znacznym przegięciem (lub „załamaniem”) krzywej miareczkowania , gdzie odpowiedź czujnika jest wykreślana w funkcji ilości dostarczonego titranta .
Jednak energia swobodna jest tylko jednym z trzech powiązanych parametrów opisujących każdą reakcję chemiczną:
- 000 Δ H = Δ G + T Δ S (2)
Gdzie:
- 0 Δ H = zmiana entalpii
- 0 Δ G = zmiana energii swobodnej
- 0 Δ S = zmiana entropii
- T = temperatura w K
Dla każdej reakcji, w której energii swobodnej nie przeciwstawia się zmiana entropii, zmiana entalpii będzie znacznie większa niż energia swobodna. Tak więc miareczkowanie oparte na zmianie temperatury (które umożliwia obserwację zmiany entalpii) będzie wykazywać większe przegięcie niż krzywe uzyskane z czujników reagujących wyłącznie na zmiany energii swobodnej.
Miareczkowania termometryczne
W miareczkowaniu termometrycznym titrant dodaje się ze znaną stałą szybkością do titrandu, aż zakończenie reakcji zostanie wskazane przez zmianę temperatury. Punkt końcowy jest określany przez przegięcie krzywej generowanej przez wyjście urządzenia do pomiaru temperatury.
Rozważ reakcję miareczkowania:
- a A + b B = p P. (3)
Gdzie:
- A = titrant, a = odpowiednia liczba moli reagujących
- B = analit, oraz b = odpowiednia liczba moli reagujących
- P = produkt, a p = odpowiadająca liczba wyprodukowanych moli
Po zakończeniu reakcja wytwarza molowe ciepło reakcji Δ H r , które jest pokazane jako mierzalna zmiana temperatury Δ T . W idealnym układzie, w którym nie występują straty ani zyski ciepła pod wpływem czynników środowiskowych, przebieg reakcji obserwuje się jako stały wzrost lub spadek temperatury w zależności odpowiednio od tego, czy Δ H r jest ujemne (co wskazuje na reakcję egzotermiczną ) , czy dodatni (co wskazuje na reakcję endotermiczną). W tym kontekście wpływy środowiskowe mogą obejmować (w kolejności ważności):
- Straty lub zyski ciepła z zewnątrz systemu przez ściany naczynia i pokrywę;
- Różnice temperatur między titrantem a titrandem;
- Straty spowodowane parowaniem z powierzchni szybko mieszającej się cieczy;
- Ciepła rozpuszczania, gdy rozpuszczalnik titranta miesza się z rozpuszczalnikiem analitu;
- Ciepło wprowadzane przez mechaniczne działanie mieszania (niewielki wpływ); I
- Ciepło wytwarzane przez sam termistor (bardzo niewielki wpływ).
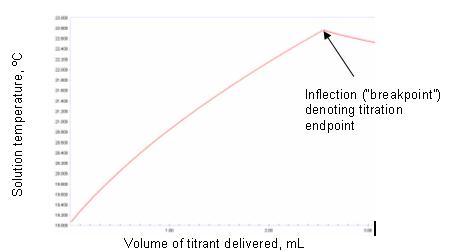
Jeśli równowaga reakcji leży daleko w prawo (tj. równowaga stechiometryczna została osiągnięta), to kiedy cały analit przereagował przez titrant, dalsze dodawanie titranta zostanie ujawnione przez ostre załamanie krzywej temperatura/objętość. Ryciny 1a i 1b ilustrują wyidealizowane przykłady.
Kształt otrzymanych eksperymentalnie wykresów miareczkowania termometrycznego będzie się różnił od takich wyidealizowanych przykładów, a niektóre z wymienionych powyżej wpływów środowiskowych mogą mieć wpływ. Można zaobserwować krzywiznę w punkcie końcowym. Może to być spowodowane niewrażliwością czujnika lub powolnym osiągnięciem równowagi termicznej w punkcie końcowym. Może również wystąpić, gdy reakcja między titrantem a titrandem nie przebiega do stechiometrycznego zakończenia. Wyznacznikiem stopnia, w jakim reakcja przebiegnie do końca, jest zmiana energii swobodnej. Jeśli jest to korzystne, wówczas reakcja będzie przebiegać do końca i będzie zasadniczo stechiometryczna. W tym przypadku ostrość punktu końcowego zależy od wielkości zmiany entalpii. Jeśli jest niekorzystna, punkt końcowy zostanie zaokrąglony niezależnie od wielkości zmiany entalpii. Reakcje, w których widoczne są niestechiometryczne równowagi, można wykorzystać do uzyskania zadowalających wyników przy użyciu metody miareczkowania termometrycznego. Jeśli części krzywej miareczkowania zarówno przed, jak i za punktem końcowym są w miarę liniowe, to przecięcie stycznych do tych linii pozwoli dokładnie zlokalizować punkt końcowy. Jest to zilustrowane na rysunku 2.
Rozważ reakcję dla równania a A + b B = p P, które jest niestechiometryczne w stanie równowagi. Niech A reprezentuje titrant, a B titrand. Na początku miareczkowania titrand B jest w silnym nadmiarze, a reakcja zbliża się do końca. W tych warunkach, dla stałej szybkości dodawania titranta, wzrost temperatury jest stały, a krzywa jest zasadniczo liniowa aż do osiągnięcia punktu końcowego. W podobny sposób, gdy titrant jest w nadmiarze poza punkt końcowy, można również przewidzieć liniową odpowiedź temperaturową. W ten sposób przecięcie stycznych ujawni prawdziwy punkt końcowy.
Rzeczywisty wykres miareczkowania termometrycznego do oznaczania mocnej zasady mocnym kwasem przedstawiono na rysunku 3.
Stwierdzono, że najbardziej praktycznym czujnikiem do pomiaru zmian temperatury w roztworach do miareczkowania jest termistor. Termistory to małe urządzenia półprzewodnikowe, które wykazują stosunkowo duże zmiany rezystancji elektrycznej przy niewielkich zmianach temperatury. Produkowane są ze spiekanych mieszanych tlenków metali, z przewodami ołowianymi umożliwiającymi podłączenie do obwodów elektrycznych. Termistor jest zamknięty w odpowiednim środku izolującym elektrycznie o zadowalających właściwościach przenoszenia ciepła i akceptowalnej odporności chemicznej. Zazwyczaj w przypadku termistorów używanych do analizy chemicznej medium otaczającym jest szkło, chociaż termistory zamknięte w żywicy epoksydowej mogą być stosowane w okolicznościach, w których spodziewany jest atak chemiczny (np. przez kwaśne roztwory zawierające fluor) lub poważne obciążenie mechaniczne. Termistor jest obsługiwany przez odpowiednie obwody elektroniczne, aby zmaksymalizować czułość na niewielkie zmiany temperatury roztworu. Obwody w module interfejsu do miareczkowania termometrycznego Metrohm 859 Titrotherm są w stanie rozwiązywać zmiany temperatury nawet do 10 −5 K.
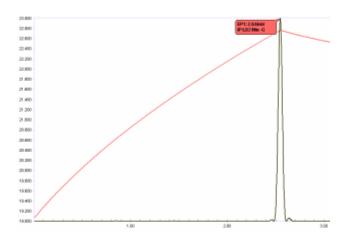
Krytycznym elementem nowoczesnego zautomatyzowanego miareczkowania termometrycznego jest możliwość zlokalizowania punktu końcowego z wysokim stopniem powtarzalności. Jest to oczywiście niepraktyczne i niewystarczające dla współczesnych wymagań dokładności i precyzji oszacowanie przegięcia przez przecięcie stycznych . Dogodnie wykonuje się to przez derywatyzację krzywej temperatury. Druga pochodna zasadniczo lokalizuje przecięcie stycznych do krzywej temperatury bezpośrednio przed i za punktem przerwania.
Termistory szybko reagują na niewielkie zmiany temperatury, takie jak gradienty temperatury w mieszanym roztworze do miareczkowania, w związku z czym sygnał może wykazywać niewielką ilość szumów. Dlatego przed derywatyzacją konieczne jest cyfrowe wygładzenie (lub „przefiltrowanie”) krzywej temperatury w celu uzyskania ostrych, symetrycznych „szczytów” drugiej pochodnej, które dokładnie zlokalizują właściwy punkt przegięcia. Zilustrowano to na rysunku 5. Stopień wygładzenia cyfrowego jest optymalizowany dla każdego oznaczenia i jest zapisywany jako parametr metody do zastosowania za każdym razem, gdy przeprowadzane jest miareczkowanie dla tej konkretnej analizy.
Ponieważ zmiana entalpii jest uniwersalną cechą reakcji chemicznych, termometryczne wykrywanie punktu końcowego można zastosować w szerokim zakresie rodzajów miareczkowania, np.
Ponadto, ponieważ czujnik nie musi wchodzić w interakcję elektrochemiczną z roztworem do miareczkowania, można przeprowadzać miareczkowania w ośrodkach nieprzewodzących, podobnie jak miareczkowania z wykorzystaniem reakcji, dla których nie jest dostępny wygodny ani opłacalny czujnik potencjometryczny.
Miareczkowanie termometryczne na ogół wymaga szybkiej kinetyki reakcji w celu uzyskania ostrych, powtarzalnych punktów końcowych. Tam, gdzie kinetyka reakcji jest powolna, a bezpośrednie miareczkowanie między titrantem a titrandem nie jest możliwe, często można opracować miareczkowanie pośrednie lub miareczkowanie wsteczne, aby rozwiązać problem.
katalitycznie mogą być stosowane w niektórych przypadkach, gdy zmiana temperatury w punkcie końcowym jest bardzo mała, a oprogramowanie do miareczkowania nie wykrywałoby punktów końcowych w zadowalający sposób.
Przydatność określonej reakcji chemicznej jako kandydata do procedury miareczkowania termometrycznego można ogólnie przewidzieć na podstawie oszacowanej ilości analitu obecnego w próbce i entalpii reakcji. Jednak inne parametry, takie jak kinetyka reakcji, sama matryca próbki , ciepło rozcieńczania i straty ciepła do otoczenia, mogą mieć wpływ na wynik. Właściwie zaprojektowany program eksperymentalny jest najbardziej niezawodnym sposobem określenia wykonalności metody miareczkowania termometrycznego. Udane zastosowania miareczkowania termometrycznego są na ogół tam, gdzie kinetyka reakcji titrant-titrand jest szybka, a równowaga chemiczna jest stechiometryczna lub prawie taka.
Gdzie mogą być zalecane termometryczne oznaczenia miareczkowania
- Analityk chce uprościć przeprowadzanie różnych miareczkowań, używając jednego czujnika dla wszystkich. Na przykład laboratorium może rutynowo przeprowadzać miareczkowanie kwasowo-zasadowe, redoks, kompleksometryczne, siarczanowe i chlorkowe. Pojedynczy czujnik termometryczny w połączeniu z autosamplerem umożliwi wykonanie wszystkich miareczkowań w tym samym obciążeniu karuzeli bez konieczności zmiany czujników miareczkowania. Po przygotowaniu próbek i umieszczeniu ich w karuzeli analityk przypisuje odpowiednią metodę termometryczną do pozycji zlewki w karuzeli.
- Środowisko miareczkowania jest uważane za nieodpowiednie dla konwencjonalnych czujników miareczkowych. Na przykład elektrody pH z membraną szklaną muszą być odpowiednio nawodnione, aby działały prawidłowo. Użycie takich elektrod w ośrodkach zasadniczo niewodnych, jak w przypadku oznaczania śladowych kwasów w lipidach i olejach smarowych, może prowadzić do utraty wydajności, ponieważ membrana zanieczyszcza się i odwadnia i/lub jeśli złącze referencyjne jest częściowo lub całkowicie zablokowane. Często konieczne jest utrzymywanie pewnej liczby elektrod cyklicznie w ramach programu odmładzania, aby nadążyć za obciążeniem pracą analityczną. Czujniki termometryczne nie wchodzą w interakcje elektrochemiczne z roztworem do miareczkowania i dlatego mogą być używane w sposób ciągły, zasadniczo bez konserwacji. Podobnie potencjometryczne miareczkowanie siarczanu za pomocą chlorek baru w różnych próbkach przemysłowych może prowadzić do szybkiej degradacji wskaźnikowej elektrody jonoselektywnej baru.
- Metodologia miareczkowania termometrycznego, której nie można naśladować przy użyciu innych typów czujników do miareczkowania, zapewni lepsze lub nieosiągalne w inny sposób wyniki innymi technikami. Przykładami są oznaczanie fluorków przez miareczkowanie kwasem borowym, analiza ortofosforanów przez miareczkowanie jonami magnezu oraz bezpośrednie miareczkowanie glinu jonami fluorkowymi.
Aparatura i konfiguracja do automatycznego miareczkowania termometrycznego
Odpowiednia konfiguracja do zautomatyzowanego miareczkowania termometrycznego obejmuje:
- Urządzenia do precyzyjnego dozowania płynów – „biurety” – do dodawania titrantów i dozowania innych odczynników
- Czujnik termometryczny oparty na termistorze
- Naczynie do miareczkowania
- Mieszadło, zdolne do bardzo wydajnego mieszania zawartości naczynia bez rozpryskiwania
- Komputer z systemem operacyjnym do miareczkowania termometrycznego
- Moduł interfejsu miareczkowania termometrycznego – reguluje przepływ danych między biuretami, czujnikami i komputerem
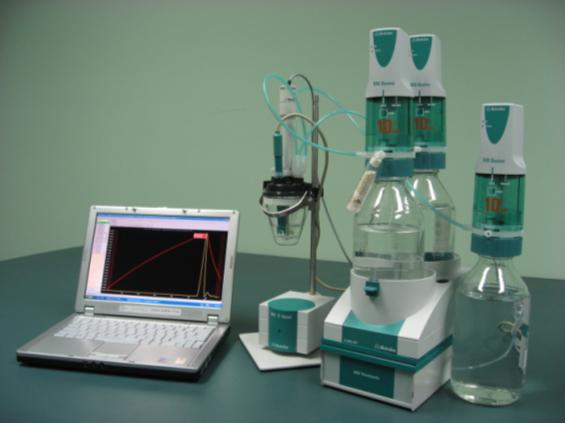
Rysunek 6 ilustruje nowoczesny zautomatyzowany system miareczkowania termometrycznego oparty na module interfejsu Metrohm 859 Titrotherm z czujnikiem Thermoprobe, urządzeniami dozującymi Metrohm 800 Dosino i komputerem z uruchomionym oprogramowaniem operacyjnym.
Figura 7 to schemat relacji między składnikami w zautomatyzowanym systemie miareczkowania termometrycznego.
A = urządzenie dozujące B = czujnik termometryczny C = urządzenie mieszające D = moduł interfejsu miareczkowania termometrycznego E = komputer
Rodzaje miareczkowania termometrycznego
Zastosowania miareczkowania termometrycznego pochodzą z głównych grup, a mianowicie:
- Miareczkowanie kwasowo-zasadowe
- Miareczkowanie redoks
- Miareczkowanie opadowe
- Miareczkowanie kompleksometryczne
Ponieważ czujnik nie oddziałuje elektrycznie ani elektrochemicznie z roztworem, przewodność elektryczna ośrodka do miareczkowania nie jest warunkiem wstępnym oznaczenia. W razie potrzeby miareczkowanie można przeprowadzić w całkowicie nieprzewodzącym, niepolarnym środowisku. Ponadto, miareczkowania można prowadzić w mętnych roztworach lub nawet zawiesinach ciał stałych i można rozważać miareczkowania, w których osady są produktami reakcji. Zakres możliwych zastosowań miareczkowania termometrycznego znacznie przekracza rzeczywiste doświadczenie tego autora, a czytelnik zostanie w niektórych przypadkach odesłany do odpowiedniej literatury.
Miareczkowanie kwasowo-zasadowe
Oznaczanie całkowicie zdysocjowanych kwasów i zasad.
Ciepło neutralizacji całkowicie zdysocjowanego kwasu z całkowicie zdysocjowaną zasadą wynosi około –56 kJ/mol. Reakcja jest zatem silnie egzotermiczna i stanowi doskonałą podstawę do szerokiego zakresu analiz w przemyśle. Zaletą dla analityka przemysłowego jest to, że zastosowanie silniejszych titrantów (1 do 2 mol/l) pozwala na zmniejszenie ilości przygotowania próbki, a próbki często można bezpośrednio i dokładnie dozować do naczynia do miareczkowania przed miareczkowaniem.
Miareczkowanie słabych kwasów
0 Słabo zdysocjowane kwasy dają ostre termometryczne punkty końcowe po miareczkowaniu mocną zasadą. Na przykład wodorowęglan można jednoznacznie oznaczyć w towarzystwie węglanu przez miareczkowanie hydroksylem (Δ H r = -40,9 kJ/mol).
Miareczkowanie mieszanin kwasów
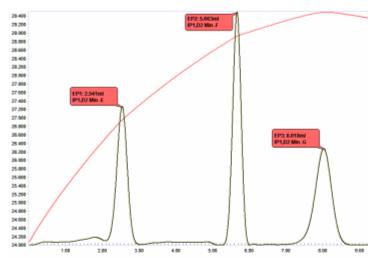
Mieszaniny złożonych kwasów można rozdzielić przez miareczkowanie termometryczne mianowanym NaOH w roztworze wodnym. W mieszaninie kwasu azotowego, octowego i fosforowego stosowanej do produkcji półprzewodników na podstawie stałych dysocjacji kwasów można przewidzieć trzy punkty końcowe:
| Punkt końcowy 1 | Punkt końcowy 2 | Punkt końcowy 3 |
|---|---|---|
| HNO 3
(p Ka = -1,3) |
HOAc (pKa = 4,75) |
|
| H 3 PO 4
(pKa 1 = 2,12) |
H 3 PO 4
(pKa 2 = 7,21) |
H 3 PO 4
(pKa 3 = 12,36) |
Kluczem do określenia ilości każdego kwasu obecnego w mieszaninie jest możliwość uzyskania dokładnej wartości ilości obecnego kwasu fosforowego, jak wykazano przez miareczkowanie trzeciego protonu H 3 PO 4 .
Figura 10 ilustruje wykres miareczkowania tej mieszaniny, pokazujący 3 ostre punkty końcowe.
Miareczkowanie złożonych roztworów alkalicznych
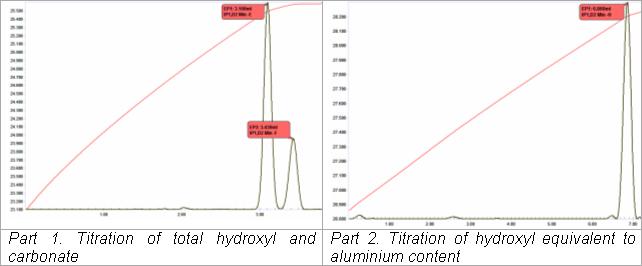
Termometryczna analiza miareczkowa ługu glinianu sodu („ ług Bayera ”) w produkcji tlenku glinu z boksytu przeprowadza się w zautomatyzowanej sekwencji dwóch miareczkowań. Jest to adaptacja klasycznej aplikacji do miareczkowania termometrycznego (VanDalen i Ward, 1973). W pierwszym miareczkowaniu roztwór winianu dodaje się do porcji ługu w celu kompleksowania glinianu, uwalniając jeden mol grupy hydroksylowej na każdy mol obecnego glinianu. Jest to miareczkowane kwasowo wraz z obecnymi „wolnymi” grupami hydroksylowymi i zawartością węglanów (jako drugi punkt końcowy). Drugie miareczkowanie poprzedzone jest automatycznym dodaniem roztworu fluorku. Kompleks tlenek glinu-winian jest rozbijany na korzyść tworzenia kompleksu fluorku glinu i jednoczesnego uwalniania trzech moli grupy hydroksylowej na każdy mol obecnego glinu, które są następnie miareczkowane kwasowo. Całe oznaczenie można zakończyć w mniej niż 5 minut.
Niewodne miareczkowania kwasowo-zasadowe
Niewodne miareczkowania kwasowo-zasadowe można korzystnie przeprowadzić za pomocą termometrów.
Kwaśne roztwory ługujące z niektórych kopalń miedzi mogą zawierać duże ilości Fe(III) oraz Cu(II). Zawartość „wolnego kwasu” ( kwasu siarkowego ) w tych roztworach ługujących jest krytycznym parametrem procesu. Podczas gdy miareczkowanie termometryczne pozwala określić zawartość wolnych kwasów przy niewielkich ilościach Fe(III), w niektórych roztworach zawartość Fe(III) jest tak wysoka, że powoduje poważne zakłócenia. Kompleksowanie z koniecznie dużymi ilościami szczawianu jest niepożądane ze względu na toksyczność odczynnika. Miareczkowanie termometryczne opracowano przez rozcieńczenie próbki propan-2-olem i miareczkowanie standardowym KOH w propan-2-olu. Większość zawartości metalu wytrąciła się przed rozpoczęciem miareczkowania i uzyskano wyraźny, ostry punkt końcowy dla zawartości kwasu siarkowego.
Katalizowane miareczkowanie termometryczne kwasowo-zasadowe do punktu końcowego
Oznaczanie kwasów śladowych w matrycach organicznych jest częstym zadaniem analitycznym przypisywanym miareczkowaniu. Przykładami są całkowita liczba kwasowa (TAN) w olejach mineralnych i smarowych oraz wolne kwasy tłuszczowe (FFA) w jadalnych tłuszczach i olejach. Zautomatyzowanym procedurom miareczkowania potencjometrycznego nadano status metody standardowej, na przykład przez ASTM dla TAN i AOAC dla FFA. Metodologia jest podobna w obu przypadkach. Próbkę rozpuszcza się w odpowiedniej mieszaninie rozpuszczalników; powiedzmy węglowodór i alkohol, które również muszą zawierać niewielką ilość wody. Woda ma na celu zwiększenie przewodności elektrycznej roztworu. Kwasy śladowe są miareczkowane standardową zasadą w alkoholu. Środowisko próbki jest zasadniczo nieprzyjazne dla elektrody pH używanej do wykrywania miareczkowania. Elektrodę należy regularnie wyłączać z eksploatacji w celu ponownego nawilżenia szklanej membrany czujnikowej, która również jest narażona na zanieczyszczenie oleistym roztworem próbki.
Niedawna termometryczna procedura miareczkowa do oznaczania FFA opracowana przez Cameiro i in. (2002) okazał się szczególnie podatny na automatyzację. Jest szybka, bardzo precyzyjna, a wyniki bardzo dobrze zgadzają się z wynikami uzyskanymi oficjalną metodą AOAC. Zmiana temperatury do miareczkowania bardzo słabych kwasów, takich jak kwas oleinowy, o 0,1 mol/L KOH w propan-2-olu jest zbyt mała, aby uzyskać dokładny punkt końcowy. W tej procedurze przed miareczkowaniem do titrandu dodaje się niewielką ilość paraformaldehydu w postaci drobnego proszku. W punkcie końcowym pierwszy nadmiar jonów hydroksylowych katalizuje depolimeryzację paraformaldehydu. Reakcja jest silnie endotermiczna i daje ostre przegięcie. Wykres miareczkowania przedstawiono na rycinie 13. Szybkość tego miareczkowania w połączeniu z jego precyzją i dokładnością sprawia, że idealnie nadaje się do analizy wolnych kwasów tłuszczowych w surowcach i produktach biodiesla.
Miareczkowania redoks
Miareczkowanie nadmanganianem i dichromianem
00 Reakcje redoks są zwykle silnie egzotermiczne i mogą być doskonałymi kandydatami do miareczkowania termometrycznego. W klasycznym oznaczaniu jonów żelazawych nadmanganianem entalpia reakcji jest ponad dwukrotnie większa niż w przypadku miareczkowania mocnym kwasem/mocną zasadą: Δ Hr = −123,9 kJ/mol Fe. Oznaczanie nadtlenku wodoru metodą miareczkowania nadmanganianem jest jeszcze silniej egzotermiczne przy Δ Hr = −149,6 kJ /mol H 2 O 2
Miareczkowanie tiosiarczanem
Przy oznaczaniu podchlorynu (na przykład w komercyjnych preparatach wybielających) można zastosować bezpośrednie miareczkowanie tiosiarczanem bez uciekania się do jodometrycznego wykańczania.
- ClO − + H 2 O + 2e − ↔ Cl − + 2OH −
- 2S 2 O 3 2− S 4 O 6 2− + 2e −
- ↔
- 2S 2 O 3 2− +ClO − +H 2O ↔ S 4O 6 2 − +Cl − +2OH −
Praktyczne są również termometryczne miareczkowania jodometryczne z tiosiarczanem jako titrantem, na przykład przy oznaczaniu Cu(II). W tym przypadku stwierdzono, że korzystne jest włączenie reagenta w postaci jodku potasu z titrantem tiosiarczanowym w takich proporcjach, aby jod uwalniał się do roztworu tuż przed jego redukcją tiosiarczanem. Minimalizuje to straty jodu podczas miareczkowania.
Miareczkowanie podchlorynem
Chociaż stosunkowo niestabilny i wymagający częstej standaryzacji, podchloryn sodu był stosowany w bardzo szybkiej metodzie miareczkowania termometrycznego do oznaczania jonów amonowych. Jest to alternatywa dla klasycznego podejścia polegającego na destylacji amoniaku z roztworu zasadowego i wynikającego z tego miareczkowania kwasowo-zasadowego. Miareczkowanie termometryczne prowadzi się w roztworze wodorowęglanu zawierającym jon bromkowy (Brown i in., 1969).
Miareczkowanie kompleksometryczne (EDTA).
Zademonstrowano miareczkowanie termometryczne z użyciem soli sodowych kwasu etylenodiaminotetraoctowego (EDTA) do oznaczania szeregu jonów metali. Entalpie reakcji są niewielkie, więc miareczkowania są zwykle przeprowadzane przy stężeniu titranta 1 mol/L. Wymaga to zastosowania soli tetrasodowej EDTA zamiast bardziej powszechnej soli disodowej, która jest nasycona w stężeniu zaledwie około 0,25 mola/l.
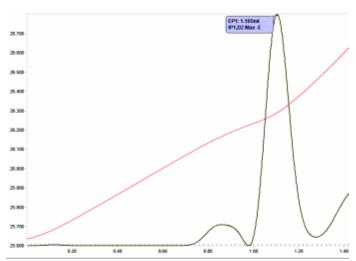
Doskonałym zastosowaniem jest sekwencyjne oznaczanie wapnia i magnezu. Chociaż wapń reaguje egzotermicznie z EDTA (ciepło chelatowania ~-23,4 kJ/mol), magnez reaguje endotermicznie z ciepłem chelatowania ~+20,1 kJ/mol. Ilustruje to wykres miareczkowania EDTA z wapniem i magnezem w wodzie morskiej (ryc. 14). Podążając za krzywą temperatury roztworu, po punkcie załamania zawartości wapnia (punkt końcowy zaznaczony na czerwono) następuje obszar niewielkiego wzrostu temperatury w wyniku konkurencji między ciepłem rozcieńczania titranta roztworem a reakcją endotermiczną Mg 2+ i EDTA. Punkt przerwania zużycia Mg 2+ (punkt końcowy zaznaczony na niebiesko) przez EDTA ujawnia się przez wzrost temperatury spowodowany wyłącznie ciepłem rozcieńczania.
Bezpośrednie miareczkowanie EDTA jonami metali jest możliwe, gdy kinetyka reakcji jest szybka, np. cynku, miedzi, wapnia i magnezu. Jednak przy wolniejszej kinetyce reakcji, takiej jak ta wykazywana przez kobalt i nikiel, stosuje się miareczkowanie wsteczne. Miareczkowania kobaltu i niklu przeprowadza się w środowisku amoniakalnym; buforowane amoniakiem: roztworem chlorku amonu. Dodaje się nadmiar EDTA i ponownie miareczkowa się roztworem Cu(II). Postuluje się, że punkt przerwania ujawnia się na podstawie różnicy entalpii reakcji między tworzeniem kompleksu Cu-EDTA, a tworzeniem kompleksu Cu-amina.
Katalizowana procedura punktu końcowego w celu określenia śladowych ilości jonów metali w roztworze (do około 10 mg/L) wykorzystuje 0,01 mol/L EDTA. Zostało to zastosowane do oznaczania niskiego poziomu Cu(II) w specjalistycznych kąpielach galwanicznych oraz do oznaczania twardości całkowitej wody. Entalpie reakcji EDTA z większością jonów metali są często dość niskie i zazwyczaj stosuje się stężenia titranta około 1 mol/l z proporcjonalnie dużymi ilościami titrandu w celu uzyskania ostrych, powtarzalnych punktów końcowych. Stosując katalitycznie wskazany punkt końcowy, można zastosować bardzo niskie stężenia titranta EDTA. Stosowane jest miareczkowanie wsteczne. Dodaje się nadmiar roztworu EDTA. Nadmiar EDTA jest ponownie miareczkowany odpowiednim jonem metalu, takim jak Mn 2+ lub Cu 2+ . W punkcie końcowym pierwszy nadmiar jonu metalu katalizuje silnie egzotermiczną reakcję między fenolem wielowodorotlenowym (takim jak rezorcyna) a nadtlenkiem wodoru.
Miareczkowanie opadów
Miareczkowanie termometryczne jest szczególnie przydatne do oznaczania szeregu analitów, w których w reakcji z titrantem tworzy się osad. W niektórych przypadkach można zaproponować alternatywę dla tradycyjnej praktyki miareczkowania potencjometrycznego. W innych przypadkach można zastosować reakcje chemiczne, dla których nie ma zadowalającego odpowiednika w miareczkowaniu potencjometrycznym.
Miareczkowanie azotanem srebra
Termometryczne miareczkowania azotanu srebra halogenkami i cyjankami są możliwe. Reakcja azotanu srebra z chlorkiem jest silnie egzotermiczna. Na przykład entalpia reakcji Ag + z Cl - jest wysoka -61,2 kJ/mol. Pozwala to na wygodne oznaczanie chlorków za pomocą powszechnie dostępnego wzorca 0,1 mol/l AgNO 3 . Punkty końcowe są bardzo ostre i ostrożnie można analizować stężenia chlorków do 15 mg/l. Bromek i chlorek można oznaczyć w mieszaninie.
Miareczkowanie siarczanu
Siarczany można szybko i łatwo miareczkować termometrycznie przy użyciu roztworów wzorcowych Ba 2+ jako titranta. Na skalę przemysłową procedura została zastosowana do oznaczania siarczanów w solankach (w tym solankach z elektrolizy), w roztworach rafinacyjnych niklu, a zwłaszcza siarczanów w kwasie fosforowym w procesie mokrym , gdzie okazała się dość popularna. Procedurę można również wykorzystać jako pomoc w analizie złożonych mieszanin kwasów zawierających kwas siarkowy , gdy nie jest możliwe zastosowanie miareczkowania w środowisku niewodnym.
Entalpia reakcji tworzenia siarczanu baru wynosi skromnie -18,8 kJ/mol. Może to nałożyć ograniczenie na dolną granicę siarczanu w próbce, którą można analizować.
Miareczkowanie aluminium fluorkiem
Miareczkowanie termometryczne oferuje szybką i bardzo precyzyjną metodę oznaczania glinu w roztworze. Roztwór glinu kondycjonuje się buforem octanowym i nadmiarem jonów sodu i potasu. Miareczkowanie fluorkiem sodu lub potasu prowadzi do egzotermicznego wytrącenia nierozpuszczalnej soli fluorku glinu.
- Al 3+ + Na + + 2K + + 6F − ↔ K 2 NaAlF 6 ↓
Ponieważ 6 moli fluoru reaguje z jednym molem glinu, miareczkowanie jest szczególnie precyzyjne, aw analizie ałunu uzyskano współczynnik wariancji (CV) równy 0,03.
Gdy jako titrant stosuje się jon glinu (powiedzmy jako azotan glinu), fluorki można oznaczyć przy użyciu tej samej chemii. To miareczkowanie jest przydatne do oznaczania fluorków w złożonych mieszaninach kwasów stosowanych jako środki trawiące w przemyśle półprzewodników.
Miareczkowanie całkowitego ortofosforanu
Jon ortofosforanowy można dogodnie miareczkować termometrycznie jonami magnezu w obecności jonu amonowego. Porcję próbki buforuje się do około pH 10 roztworem NH3 / NH4Cl .
Reakcja:
- Mg 2+ + NH 4 + + PO 4 3− ↔ MgNH 4 PO 4 ↓
Jest egzotermiczny. W aplikacjach testowych osiągnięto CV poniżej 0,1. Procedura jest odpowiednia do oznaczania ortofosforanów w nawozach i innych produktach.
Miareczkowanie niklu
Nikiel można miareczkować termometrycznie, stosując dimetyloglioksymat disodowy jako titrant. Chemia jest analogiczna do klasycznej procedury grawimetrycznej, ale czas oznaczania można skrócić z wielu godzin do kilku minut. Należy wziąć pod uwagę potencjalne zakłócenia.
Miareczkowanie surfaktantów anionowych i kationowych
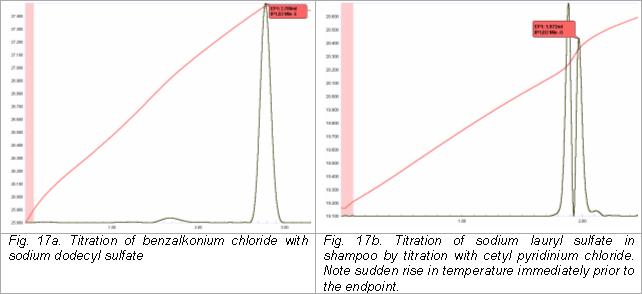
Anionowe i kationowe środki powierzchniowo czynne można oznaczyć termometrycznie przez miareczkowanie jednego rodzaju względem drugiego. Na przykład chlorek benzalkoniowy (kationowy środek powierzchniowo czynny typu czwartorzędowego) można oznaczyć w środkach czyszczących i algicydach do basenów i spa przez miareczkowanie mianowanym roztworem dodecylosiarczanu sodu. Alternatywnie anionowe środki powierzchniowo czynne, takie jak laurylosiarczan sodu, można miareczkować chlorkiem cetylopirydyniowym .
Miareczkowanie niejonowych środków powierzchniowo czynnych
Po dodaniu nadmiaru Ba 2+ do niejonowego środka powierzchniowo czynnego typu pochodnej tlenku alkilopropylenu powstaje kompleks pseudokationowy. Można to miareczkować standardowym tetrafenyloboranem sodu. Dwa mole tetrafenyloboranu reagują z jednym molem kompleksu Ba 2+ / niejonowy środek powierzchniowo czynny.
Różne miareczkowania wodne
Miareczkowanie fluorków kwasem borowym
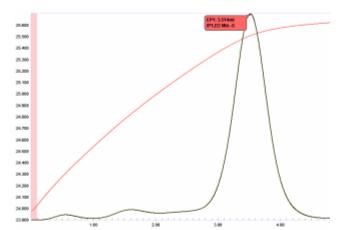
Kwaśne roztwory fluorków (w tym kwasu fluorowodorowego) można oznaczyć za pomocą prostego miareczkowania termometrycznego kwasem borowym.
- B(OH) 3 + 3F − + 3H + ↔ BF 3 + 3H 2 O
Wykres miareczkowania przedstawiony na rycinie 19 pokazuje, że punkt końcowy jest dość zaokrąglony, co sugeruje, że reakcja może nie przebiegać do równowagi stechiometrycznej. Ponieważ jednak obszary krzywej temperatury bezpośrednio przed i za punktem końcowym są dość liniowe, druga pochodna tej krzywej (reprezentująca przecięcie stycznych) dokładnie zlokalizuje punkt końcowy. Rzeczywiście, przy tym miareczkowaniu można uzyskać doskonałą precyzję, z CV mniejszym niż 0,1.
Oznaczanie formaldehydu
Formaldehyd można oznaczyć w bezprądowych roztworach do powlekania miedzi przez dodanie nadmiaru roztworu siarczynu sodu i miareczkowanie uwolnionego jonu hydroksylowego mianowanym kwasem.
- H 2 C=O + HSO 3 − + H 2 O → [HO-CH 2 -SO 3 − ] + OH −
- JM Bella i CF Cowella. J. Am. chemia soc. 35 , 49-54 (1913)
- E. VanDalen i LG Ward. Termometryczne oznaczanie miareczkowe wodorotlenków i tlenku glinu metodą Bayera
rozwiązania. Analny. chemia 45 (13) 2248-2251, (1973)
- MJD Carneiro, MA Feres Júnior i OES Godinho. Oznaczanie kwasowości olejów za pomocą paraformaldehydu jako termometrycznego wskaźnika punktu końcowego. J. Braz. chemia soc. 13 (5) 692-694 (2002)
Bibliografia
- Kora, LS i Kora, SM; (1969). Miareczkowanie termometryczne. Międzynarodowa seria monografii w chemii analitycznej, tom 33 Pergamon Press (Oxford) Biblioteka Kongresu Karta katalogowa nr 68-57883
- Bartel, J.; (1975) Miareczkowania termometryczne. John Wiley & Sons, Nowy Jork. ISBN 0-471-05448-8 Karta katalogowa Biblioteki Kongresu nr 75-17503
- Eatough, DJ; Christensen, JJ & Izatt RM; (1974) Eksperymenty z miareczkowania termometrycznego i kalorymetrii miareczkowej. Brigham Young University Press , Provo, Utah . ISBN 0-8425-0145-2 Karta katalogowa Biblioteki Kongresu 74-13074
- Grime, JK; (1985) Analityczna kalorymetria roztworów. John Wiley & Sons, Nowy Jork. ISBN 0-471-86942-2 Karta katalogowa Biblioteki Kongresu nr 84-28424
- Vaughan, Georgia; (1973) Miareczkowanie termometryczne i entalpimetryczne. Van Nostrand Reinhold Company (Londyn) ISBN 0-442-78385-X Karta katalogowa Biblioteki Kongresu nr 79-186764
Linki zewnętrzne
- Podstawy miareczkowania termometrycznego
- IUPAC Definicja miareczkowania termometrycznego
- Monografia miareczkowania termometrycznego Metrohma