Mikrodializa
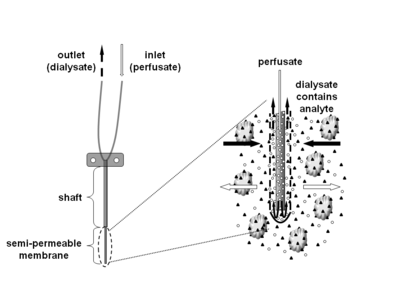
Mikrodializa to minimalnie inwazyjna technika pobierania próbek, która jest stosowana do ciągłego pomiaru stężeń wolnych, niezwiązanych analitów w płynie pozakomórkowym praktycznie każdej tkanki. Anality mogą obejmować cząsteczki endogenne (np. neuroprzekaźniki , hormony , glukozę itp.) w celu oceny ich funkcji biochemicznych w organizmie lub związki egzogenne (np. farmaceutyki ) w celu określenia ich rozmieszczenia w organizmie. Technika mikrodializy wymaga wprowadzenia małego cewnika do mikrodializy (nazywanego również sondą do mikrodializy) do tkanki będącej przedmiotem zainteresowania. Sonda do mikrodializy została zaprojektowana tak, aby naśladować kapilarę krwi i składa się z trzonu z półprzepuszczalną membraną z pustych włókien na końcu, która jest połączona z przewodami wlotowymi i wylotowymi. Sonda jest stale poddawana perfuzji z wodnym roztworem (perfuzatem), który bardzo przypomina (jonowy) skład otaczającego płynu tkankowego przy niskim natężeniu przepływu około 0,1-5 μl/min. Po wprowadzeniu do tkanki lub płynu (ustrojowego) będącego przedmiotem zainteresowania, małe substancje rozpuszczone mogą przenikać przez półprzepuszczalną błonę poprzez bierną dyfuzję . Kierunek przepływu analitu jest określony przez odpowiedni gradient stężenia i umożliwia użycie sond do mikrodializy zarówno jako narzędzi do pobierania próbek, jak i dostarczania. Roztwór opuszczający sondę (dializat) jest zbierany w określonych odstępach czasu do analizy.
Historia
Zasada mikrodializy została po raz pierwszy zastosowana na początku lat 60. XX wieku, kiedy kaniule push-pull i worki dializacyjne zostały wszczepione do tkanek zwierzęcych, zwłaszcza do mózgów gryzoni, w celu bezpośredniego badania biochemii tkanek. Chociaż techniki te miały szereg wad eksperymentalnych, takich jak liczba próbek na zwierzę lub brak / ograniczona rozdzielczość czasowa, wynalezienie dialitrod z ciągłą perfuzją w 1972 r. Pomogło przezwyciężyć niektóre z tych ograniczeń. Dalsze udoskonalanie koncepcji dialitrody zaowocowało wynalezieniem w 1974 r. „pustych włókien”, rurkowej półprzepuszczalnej membrany o średnicy ~ 200-300 μm. Obecnie najbardziej rozpowszechniony kształt, sonda igłowa, składa się z trzonu z pustym włóknem na końcu i może być wprowadzony za pomocą kaniuli prowadzącej do mózgu i innych tkanek. Alternatywna metoda, mikroperfuzja otwartego przepływu (OFM), zastępuje membranę makroskopowymi otworami, co ułatwia pobieranie próbek związków lipofilowych i hydrofilowych, leków związanych i niezwiązanych z białkami, neuroprzekaźników , peptydów i białek , przeciwciał , nanocząstek i nanonośników , enzymów i pęcherzyków .
Sondy do mikrodializy
Dostępnych jest wiele sond z różnymi kombinacjami długości membrany i trzonu. Wartość odcięcia masy cząsteczkowej dostępnych w handlu sond do mikrodializy obejmuje szeroki zakres około 6-100 kD, ale dostępna jest również 1MD. Podczas gdy związki rozpuszczalne w wodzie generalnie swobodnie dyfundują przez membranę do mikrodializy, sytuacja nie jest tak jasna w przypadku wysoce lipofilowych analitów, w przypadku których odnotowano zarówno udane (np. kortykosteroidy), jak i nieudane eksperymenty z mikrodializą (np. estradiol, kwas fusydowy). Jednak odzyskiwanie związków rozpuszczalnych w wodzie zwykle gwałtownie spada, jeśli masa cząsteczkowa analitu przekracza 25% wartości granicznej masy cząsteczkowej membrany.
Metody odzyskiwania i kalibracji
Ze względu na stałą perfuzję sondy do mikrodializy świeżym perfuzatem nie można osiągnąć całkowitej równowagi. Powoduje to, że stężenia dializatu są niższe niż te zmierzone w odległym miejscu pobierania próbek. W celu skorelowania stężeń zmierzonych w dializacie ze stężeniami obecnymi w odległym miejscu pobierania próbek potrzebny jest współczynnik kalibracji (odzysk). Odzysk można określić w stanie ustalonym, stosując stałą szybkość wymiany analitu przez membranę do mikrodializy. Szybkość, z jaką analit jest wymieniany przez półprzepuszczalną membranę, jest ogólnie wyrażana jako wydajność ekstrakcji analitu. Wydajność ekstrakcji definiuje się jako stosunek utraty/zysku analitu podczas jego przejścia przez sondę (C in −C out ) i różnica w stężeniu między perfuzatem a odległym miejscem pobierania próbek (C in −C próbka ).
Teoretycznie wydajność ekstrakcji sondy do mikrodializy można określić poprzez: 1) zmianę stężeń leku przy zachowaniu stałego natężenia przepływu lub 2) zmianę natężenia przepływu przy zachowaniu stałych stężeń odpowiednich leków. W stanie ustalonym uzyskuje się taką samą wartość wydajności ekstrakcji, niezależnie od tego, czy analit jest wzbogacony, czy zubożony w perfuzacie. W konsekwencji sondy do mikrodializy można kalibrować, mierząc utratę analitu za pomocą perfuzatu zawierającego lek lub przyrost analitu za pomocą roztworów próbek zawierających lek. Do tej pory najczęściej stosowanymi metodami kalibracji są metoda niskiego natężenia przepływu, metoda bez strumienia netto, dynamiczna (rozszerzona) metoda bez strumienia netto oraz metoda retrodializy. Właściwy dobór odpowiedniej metody kalibracji ma kluczowe znaczenie dla powodzenia eksperymentu z mikrodializą. Wspierający in vitro przed zastosowaniem u zwierząt lub ludzi. Ponadto odzysk określony in vitro może różnić się od odzysku u ludzi. Dlatego jego rzeczywista wartość musi być określona w każdym eksperymencie in vivo.
Metoda niskiego natężenia przepływu
Metoda niskiego natężenia przepływu opiera się na fakcie, że wydajność ekstrakcji zależy od natężenia przepływu. Przy wysokich prędkościach przepływu ilość leku dyfundującego z miejsca pobrania próbki do dializatu w jednostce czasu jest mniejsza (niska wydajność ekstrakcji) niż przy niższych prędkościach przepływu (wysoka wydajność ekstrakcji). Przy zerowym natężeniu przepływu ustalana jest całkowita równowaga między tymi dwoma miejscami (C out = C próbka ). Ta koncepcja jest stosowana w przypadku metody (niskiego) natężenia przepływu, w której sonda jest perfundowana ślepym perfuzatem przy różnych prędkościach przepływu. Stężenie w miejscu pobierania próbek można określić, wykreślając współczynniki ekstrakcji w odniesieniu do odpowiednich natężeń przepływu i ekstrapolując do zerowego przepływu. Metoda niskiego natężenia przepływu jest ograniczona przez fakt, że czas kalibracji może być dość długi, zanim zostanie zebrana wystarczająca objętość próbki. [ potrzebne źródło ]
Metoda bez strumienia netto
Podczas kalibracji metodą bez strumienia netto sonda do mikrodializy jest poddawana perfuzji co najmniej czterema różnymi stężeniami interesującego analitu (C w ), a stężenia analitu opuszczającego sondę w stanie ustalonym są mierzone w dializacie (C na zewnątrz ). Odzyskiwanie dla tej metody można określić, wykreślając C na zewnątrz - C na C w i obliczenie nachylenia linii regresji. Jeśli stężenia analitu w perfuzacie są równe stężeniom w miejscu pobierania próbek, występuje przepływ bez przepływu netto. Odpowiednie stężenia w punkcie braku strumienia netto są reprezentowane przez punkt przecięcia z osią x linii regresji. Siła tej metody polega na tym, że w stanie ustalonym nie trzeba przyjmować żadnych założeń dotyczących zachowania związku w pobliżu sondy, ponieważ równowaga istnieje w określonym czasie i miejscu. Jednak w warunkach przejściowych (np. po prowokacji lekiem) odzyskiwanie sondy może ulec zmianie, powodując błędne oszacowania stężeń w miejscu pobierania próbek. Aby przezwyciężyć to ograniczenie, opracowano kilka podejść, które można również zastosować w warunkach nieustalonych. Jednym z takich podejść jest dynamiczna metoda bez strumienia netto.
Dynamiczna metoda bez strumienia netto
Podczas gdy jeden osobnik/zwierzę jest perfundowany wieloma stężeniami podczas metody bez strumienia netto, wielu osobników jest perfundowanych jednym stężeniem podczas metody dynamicznej bez strumienia netto (DNNF). Dane od różnych osobników/zwierząt są następnie łączone w każdym punkcie czasowym do analizy regresji umożliwiającej określenie powrotu do zdrowia w czasie. Projekt metody kalibracji DNNF okazał się bardzo przydatny w badaniach oceniających odpowiedź związków endogennych, takich jak neuroprzekaźniki, na prowokację lekiem.
Retrodializa
Podczas retrodializy sonda do mikrodializy jest perfundowana roztworem zawierającym analit i monitorowane jest znikanie leku z sondy. Odzysk dla tej metody można obliczyć jako stosunek leku utraconego podczas pasażu (C in -C out ) i leku wprowadzanego do sondy do mikrodializy (C in ). Zasadniczo retrodializa może być przeprowadzona przy użyciu samego analitu (retrodializa z użyciem leku) lub związku referencyjnego (retrodializa z użyciem kalibratora), który bardzo przypomina właściwości fizykochemiczne i biologiczne analitu. Pomimo faktu, że retrodializa za pomocą leku nie może być stosowana w przypadku związków endogennych, ponieważ wymaga braku analitu w miejscu pobierania próbki, ta metoda kalibracji jest najczęściej stosowana w przypadku związków egzogennych w warunkach klinicznych.
Aplikacje
Technika mikrodializy przeszła znaczny rozwój od czasu jej pierwszego zastosowania w 1972 r., kiedy to po raz pierwszy zastosowano ją do monitorowania stężeń endogennych biomolekuł w mózgu. Dzisiejszy obszar zastosowań rozszerzył się o monitorowanie wolnych stężeń związków endogennych i egzogennych w praktycznie każdej tkance. Chociaż mikrodializa jest nadal stosowana głównie w przedklinicznych badaniach na zwierzętach (np. gryzoniach laboratoryjnych, psach, owcach, świniach), obecnie jest coraz częściej stosowana u ludzi do monitorowania stężeń wolnych, niezwiązanych leków w tkankach, jak również stężeń śródmiąższowych cytokin regulatorowych i metabolitów w odpowiedzi na zaburzenia homeostatyczne, takie jak karmienie i/lub ćwiczenia.
W badaniach mózgu mikrodializa jest powszechnie stosowana do pomiaru neuroprzekaźników (np. dopaminy , serotoniny , norepinefryny , acetylocholiny , glutaminianu , GABA ) i ich metabolitów, a także małych neuromodulatorów (np. cAMP , cGMP , NO ), aminokwasów (np. glicyny , cysteina , tyrozyna ) oraz substraty energetyczne (np. glukoza , mleczan ). , pirogronian ). Leki egzogenne, które mają być analizowane za pomocą mikrodializy, obejmują nowe leki przeciwdepresyjne , przeciwpsychotyczne , a także antybiotyki i wiele innych leków, które mają miejsce działania farmakologicznego w mózgu. Pierwszym niemetabolitem analizowanym metodą mikrodializy in vivo w ludzkim mózgu była ryfampicyna .
Zastosowania w innych narządach obejmują skórę (ocena biodostępności i biorównoważności leków dermatologicznych stosowanych miejscowo) oraz monitorowanie stężenia glukozy u pacjentów z cukrzycą (umieszczenie sondy wewnątrznaczyniowej lub podskórnej). Ten ostatni można nawet włączyć do systemu sztucznej trzustki do automatycznego podawania insuliny.
Mikrodializa znalazła również coraz większe zastosowanie w badaniach środowiskowych, pobierając próbki różnorodnych związków ze ścieków i roztworu glebowego, w tym sacharydy, jony metali, mikroelementy, kwasy organiczne i azot o niskiej masie cząsteczkowej. Biorąc pod uwagę destrukcyjny charakter konwencjonalnych metod pobierania próbek gleby, mikrodializa może potencjalnie oszacować strumienie jonów gleby, które lepiej odzwierciedlają niezakłócone środowisko glebowe.
Analiza krytyczna
Zalety
- Jak dotąd mikrodializa jest jedyną techniką pobierania próbek in vivo , która umożliwia ciągłe monitorowanie stężenia leku lub metabolitu w płynie zewnątrzkomórkowym praktycznie każdej tkanki. W zależności od dokładnego zastosowania, stężenia analitu można monitorować przez kilka godzin, dni, a nawet tygodni. Stężenia wolnych, niezwiązanych tkanek pozakomórkowych są w wielu przypadkach szczególnie interesujące, ponieważ przypominają stężenia farmakologicznie czynne w miejscu działania lub w jego pobliżu. Połączenie mikrodializy z nowoczesnymi technikami obrazowania, takimi jak pozytonowa tomografia emisyjna , dodatkowo pozwala na określenie stężeń wewnątrzkomórkowych.
- Wprowadzenie sondy w precyzyjne miejsce wybranej tkanki pozwala ponadto na ocenę zewnątrzkomórkowych gradientów stężeń pod wpływem aktywności transportera lub innych czynników, takich jak różnice w perfuzji. W związku z tym zasugerowano, że jest to najbardziej odpowiednia technika do stosowania w badaniach dystrybucji w tkankach.
- Wymiana analitu przez półprzepuszczalną membranę i ciągła wymiana płynu pobranego na świeży perfuzat zapobiega odpływowi płynu z miejsca poboru, co pozwala na pobranie próbki bez utraty płynu. Dzięki temu mikrodializę można stosować bez zaburzania warunków tkankowych przez miejscową utratę płynów lub artefakty ciśnienia, które mogą wystąpić przy stosowaniu innych technik, takich jak mikroiniekcja lub perfuzja push-pull.
- Półprzepuszczalna membrana zapobiega przedostawaniu się komórek, resztek komórkowych i białek do dializatu. Ze względu na brak białka w dializacie, oczyszczanie próbki przed analizą nie jest potrzebne, a degradacja enzymatyczna nie stanowi problemu.
Ograniczenia
- Pomimo postępu naukowego w zmniejszaniu i zwiększaniu wydajności sond do mikrodializy, inwazyjny charakter tej techniki nadal stwarza pewne ograniczenia praktyczne i etyczne. Na przykład wykazano, że wszczepienie sondy do mikrodializy może zmienić morfologię tkanki , powodując zaburzenia mikrokrążenia, tempa metabolizmu lub integralności barier fizjologicznych, takich jak bariera krew-mózg . Podczas gdy ostre reakcje na wprowadzenie sondy, takie jak urazy związane z implantacją, wymagają wystarczającego czasu rekonwalescencji, dodatkowe czynniki, takie jak martwica , reakcje zapalne lub procesy gojenia się ran muszą być brane pod uwagę w przypadku długoterminowego pobierania próbek, ponieważ mogą one wpływać na wynik eksperymentu. Z praktycznego punktu widzenia sugeruje się przeprowadzanie eksperymentów mikrodializy w optymalnym oknie czasowym, zwykle 24–48 godzin po wprowadzeniu sondy.
- Mikrodializa ma stosunkowo niską rozdzielczość czasową i przestrzenną w porównaniu np. z bioczujnikami elektrochemicznymi . Podczas gdy rozdzielczość czasowa zależy od długości interwałów próbkowania (zwykle kilka minut), rozdzielczość przestrzenna zależy od wymiarów sondy. Rozmiar sondy może różnić się w zależności od obszaru zastosowania i obejmuje zakres od kilku milimetrów (aplikacja domózgowa) do kilku centymetrów ( podskórna ) długości i kilkuset mikrometrów średnicy. [ potrzebne źródło ]
- Zastosowanie techniki mikrodializy jest często ograniczone określeniem odzysku sondy, zwłaszcza w przypadku in vivo eksperymenty. Określenie odzysku może być czasochłonne i może wymagać dodatkowych osób lub eksperymentów pilotażowych. Odzysk zależy w dużej mierze od natężenia przepływu: im mniejsze natężenie przepływu, tym większy odzysk. Jednak w praktyce prędkości przepływu nie można zbytnio zmniejszyć, ponieważ albo objętość próbki otrzymanej do analizy będzie niewystarczająca, albo utracona zostanie rozdzielczość czasowa eksperymentu. Dlatego ważne jest, aby zoptymalizować zależność między szybkością przepływu a czułością testu analitycznego. Sytuacja może być bardziej złożona w przypadku związków lipofilowych, ponieważ mogą one przyklejać się do rurki lub innych elementów sondy, co skutkuje niskim odzyskiem analitu lub jego brakiem. [ potrzebne źródło ]