Ortoreowirus ryb
|
|
| Ortoreowirus rybny | |
|---|---|
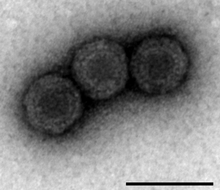
| Analiza PRV-1 przy użyciu transmisyjnej mikroskopii elektronowej (odcinek skali 100 nm). | |
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| Królestwo : | Rybowiria |
| Królestwo: | Orthornavirae |
| Gromada: | Duplornaviricota |
| Klasa: | Resentoviricetes |
| Zamówienie: | Reovirales |
| Rodzina: | Reoviridae |
| Rodzaj: | Ortoreowirus |
| Gatunek: |
Ortoreowirus ryb
|
Ortoreowirus ryb ( PRV ) to gatunek z rodzaju Orthoreowirus , który zakaża wyłącznie ryby. PRV wykryto po raz pierwszy w 2010 r. u hodowlanego łososia atlantyckiego wykazującego zapalenie serca i mięśni szkieletowych (HSMI), a jego obecność w większym stężeniu stwierdzono u ryb cierpiących na różne choroby. Choroby te obejmują HSMI, zespół żółtaczki, zespół ciemnienia proliferacyjnego i zespół włączenia ciałek erytrocytowych. Uważa się, że PRV atakuje głównie hodowle akwakultury i marikultury stad ryb, a ostatnie badania skupiały się na podatności dzikich zwierząt. Jednakże to, czy PRV jest zjadliwy w odniesieniu do HSMI, pozostaje tematem debaty. PRV znalazło się w centrum uwagi opinii publicznej głównie ze względu na potencjalne powiązanie z hodowlanym łososiem atlantyckim wykazującym HSMI. Pojawiły się obawy społeczne dotyczące możliwości przenoszenia PRV z otwartych sieci oceanicznych na populacje dzikiego łososia i powodowania spadku populacji. Nie potwierdzono, że PRV jest chorobotwórczy u dzikich zasobów łososia.
Klasyfikacja
Analiza filogenetyczna każdego segmentu genomu PRV początkowo umieściła PRV w rodzinie Reoviridae , podrodzinie Spinareovirinae , w oparciu o sekwencję i podobieństwo strukturalne do znanych reowirusów . Po odkryciu analiza sekwencji filogenetycznej wykazała, że PRV był w równym stopniu spokrewniony z wirusami z rodzajów Orthoreovirus i Aquareovirus . W rezultacie zasugerowano, że PRV ewoluował oddzielnie od wspólnego przodka spokrewnionego zarówno z ortoreowirusem , jak i Aquareowirusem z podrodziny Spinareovirinae .
Obecnie PRV jest oficjalnie klasyfikowany jako ortoreowirus. Argumentowano za umieszczeniem w rodzaju Orthoreovirus z następujących powodów:
- Wyższa wierność sekwencji w obrębie sekwencji homologicznych
- Te same numery segmentów, 10, w porównaniu z 11 w Aquareovirusie .
- Brak związanego z fuzogenem małego białka transbłonowego (FAST), białka prawie uniwersalnego w Aquareowirusie . Oznacza to również, że ortoreowirusy nie powodują powstawania syncytii wśród zakażonych komórek.
- Obecność białka przyłączającego wirusa błonnika
- Procent nukleozydów GC wynoszący 47%, co mieści się w zakresie ortoreowirusów (44–48%), a nie zakresu akwareowirusów (52–60%).
Argumenty przeciwne umieszczeniu w Orthoreowirusie ,
- Jedynym innym niefuzogennym gatunkiem ortoreowirusa jest ortoreowirus ssaczy (MRV), którego żywicielami są wyłącznie ssaki.
- Wiele aquareowirusów infekuje ryby, natomiast PRV jest jedynym znanym ortoreowirusem, który infekuje ryby.
- Sekwencje S1 i S4 w PRV nie mają znanych homologów do żadnego rodzaju
- Prawie wszystkie ortoreowirusy i aquareowirusy są bicistronowe ze względu na wirusowe białko przyłączające, podczas gdy PRV jest monocistronowy.
- PRV wykazuje w swoich segmentach sekwencje końcowe 5', które nie odpowiadają żadnemu rodzajowi.
- Istnieją gatunki Aquareowirusów zidentyfikowane jako niefuzogenne, w tym GCRV104 i GCRVGD108.
- Zewnętrzne białko klamrowe PRV znajduje się w segmencie bicistronowym S1, pierwszym ze znanych ortoreowirusów lub aquareowirusów, który koduje to białko w segmencie policistronowym.
Genom i struktura
Genom
Ortoreowirus rybi ma podzielony na segmenty genom dsRNA składający się z 10 pojedynczych segmentów liniowych, o łącznej długości około 23 600 pz. Ma zawartość GC wynoszącą 47%. Każdy segment ma zachowane sekwencje końcowe. Sekwencja końca 3' (UCAUC-3') jest taka sama jak w przypadku Ortoreowirusa i Aquareowirusa . Sekwencja końca 5' (5'-GAUAAA/U) jest unikalna dla PRV. Segmenty te są określane jako L1-3 (długi), M1-3 (średni) i S1-4 (krótki) w oparciu o długość i porównanie z homologicznymi segmentami u ortoreowirusów i akwareowirusów . L1 jest najdłuższy i ma 3916 bp, a S4 najkrótszy i ma 1040 bp.
Potwierdzono, że jedenaście białek jest kodowanych. S1 wykazuje bicistronowość z 2 nakładającymi się otwartymi ramkami odczytu, podczas gdy pozostałe białka albo potwierdzono jako monocistronowe, albo uznano je za bicistronowe bez dalszych dowodów. Białka kodowane przez każdy segment są następujące, przy użyciu ustandaryzowanego systemu nazewnictwa dla różnych rodzajów reowirusów:
- L1-λ3 – białko otoczki (białko wewnętrznego kapsydu)
- L2-λ2 - Białko wieżyczkowe, guanylotransferaza i metylotransferaza, wytłaczanie genomu.
- L3-λ1 - RdRP
- M1-μ2 - NTPaza
- M2-μ1 – białko zewnętrznego kapsydu
- M3-μNS – nieznana funkcja, przypuszczalnie pomagająca w tworzeniu fabryk wirusowych.
- S1-σ3 – białko zacisku zewnętrznego (białko kapsydu) i p13 – cytotoksyczne białko niestrukturalne
- S2-σ2 - Białko zacisku rdzenia
- S3-σNS - funkcja nieznana, niestrukturalna.
- S4-σ1 – Białko przyłączania wirusa
Podziały
Ortoreowirus rybi został pogrupowany w wiele różnych genotypów w oparciu o różnorodność sekwencji. Chociaż zaproponowano wiele sposobów podziału PRV, najczęściej stosowany w literaturze system dzieli PRV na genotypy I i II, które są dalej podzielone odpowiednio na Ia i Ib oraz IIa i IIb. Te podziały i podpodziały opierają się na różnorodności sekwencji w segmencie S1.
Genotyp I (PRV-1)
Ia
Ten podgenotyp PRV występuje głównie u łososia atlantyckiego hodowlanego w Norwegii, Chile i Kanadzie. Zostało to powiązane z populacjami wykazującymi HSMI. Stwierdzono go u hodowlanego łososia Chinook w Kanadzie wykazującego zespół żółtaczki, a także hodowlanego pstrąga tęczowego i Coho wykazującego objawy podobne do HSMI w Chile i Kanadzie.
Ib
Ten podgenotyp PRV występuje głównie u hodowlanego łososia atlantyckiego i Coho w Norwegii i Chile, a także u hodowlanego pstrąga tęczowego w Chile. Występuje w wielu łososiach z HSMI. Stwierdzono również w populacjach Coho wykazujących zespół żółtaczki.
Genotyp II
Genotyp II odkryto po raz pierwszy podczas porównywania sekwencji S1 łososia atlantyckiego hodowlanego w Chile, a następnie powtórzono go w analizie zarówno M2, jak i całego genomu. Pomimo przynależności do jednego genotypu, podgenotypy IIa i IIb wykazują znacznie większą różnorodność między sekwencjami niż Ia i Ib.
IIa (PRV-3)
PRV-3 powiązano z patologicznymi zmianami w sercu u pstrąga tęczowego. Stwierdzono go również u hodowlanych łososi Coho, pstrągów potokowych i pstrągów tęczowych wykazujących HSMI w Europie Północnej i Chile. Stwierdzono go także u dzikiego pstrąga potokowego z zespołem ciemnienia proliferacyjnego w Europie Środkowej. Porównanie z PRV-2 wykazuje podobieństwo 80,1% i 90,5% odpowiednio dla nukleotydów i aminokwasów. Porównanie z PRV-1 wykazało 72,9% podobieństwa sekwencji nukleotydów i 80,0% podobieństwa sekwencji aminokwasów.
IIb (PRV-2)
PVR-2 wykryto jedynie u hodowlanego łososia Coho w Japonii wykazującego zespół ciałka wtrętowego erytrocytarnego (EIBS). Do tej pory zsekwencjonowano tylko jeden genom PRV-2, co zmniejszyło pewność co do umiejscowienia filogenetycznego. Porównanie z PRV-1 wykazało 73,4% i 80,3% podobieństwa odpowiednio w sekwencji nukleotydowej i sekwencji aminokwasowej.
Struktura
Jako członek rodzaju Orthoreovirus , forma wirionu PRV jest bezotoczkowym kapsydem dwudziestościennym z dwiema warstwami, zewnętrzną i rdzeniową. Średnica całkowitego wirionu obejmującego warstwę zewnętrzną wynosi około 70 nm, a wewnętrzna warstwa rdzenia ma średnicę około 39 nm.
Warstwa wewnętrzna składa się z białka otoczki λ3 oraz białka wewnętrznego zacisku σ2, które, jak się uważa, odgrywa rolę w strukturalnej stabilizacji dwudziestościanu. Uważa się, że zewnętrzna warstwa odgrywa rolę stabilizującą wewnętrzny kapsyd i składa się z μ1 (białko zewnętrznego kapsydu) oraz σ3 (białko zewnętrznego zacisku). Dodatkowo warstwa zewnętrzna zawiera białka błonnikowe (σ1), które pośredniczą w przyłączaniu wirusa i jego wejściu do żywiciela.
PRV jest reowirusem wieżyczkowym, wykazującym białko wieżyczkowe (λ2) na pięciokrotnych osiach wewnętrznego dwudziestościanu kapsydu. Białka homologiczne dla L2 w MRV i ARV mają aktywność zarówno guanylotransferazy, jak i metylotransferazy. Chociaż nie całkowicie konserwatywne, aktywne regiony (λ2) wykazują wierność sekwencjom MRV i ARV, co sugeruje, że λ2 jest białkiem wieżyczkowym i odgrywa podobną rolę w czapce 5' transkrybowanego wirusowego mRNA.
Odkrycie
PRV zidentyfikowano po raz pierwszy w 2010 r. za pomocą wysokowydajnego sekwencjonowania DNA i metod bioinformatycznych, które ustaliły, że wirus jest obecny w hodowanym w mariach łososiu atlantyckim dotkniętym zapaleniem serca i mięśni szkieletowych (HSMI). Chociaż zalecono kontrolę rozprzestrzeniania się PRV, stwierdzono związek przyczynowy pomiędzy Nie wykazano wówczas PRV i HSMI.
W 2012 r. kilka gatunków dzikich ryb u wybrzeży Norwegii uzyskało pozytywny wynik testów na obecność PRV, co wskazuje, że PRV występuje w dzikich populacjach, jednak większość testów próbek dała wyniki negatywne, co wskazuje na niską częstość występowania PRV u wybrzeży Norwegii.
Spekulowano, że PRV 1a został wprowadzony na zachodnie wybrzeże Ameryki Północnej ze źródła północnoatlantyckiego. PRV 1a został wprowadzony do Chile ze źródeł Północnego Pacyfiku i Północnego Atlantyku.
Dystrybucja
Stwierdzono, że PRV występuje niemal na całym świecie, na podstawie różnych badań wykrywających obecność PRV w połowach na Atlantyku u wybrzeży Wielkiej Brytanii, Irlandii i Norwegii, a także na wybrzeżach Atlantyku i Pacyfiku u wybrzeży północy i południa Ameryka. PRV wykryto u gatunków ryb hodowlanych i dzikich z Pacyfiku, aż do Alaski i na południe aż do Chile.
PRV-1 występuje rzadziej u dzikiego łososia niż u łososia hodowlanego i chociaż dzikie trocie wędrowne mają tendencję do wykazywania infekcji PRV-3, tego samego nie można powiedzieć o populacjach dzikiego łososia atlantyckiego.
Interakcja z gospodarzem
Dynamika infekcji
Kinetykę zakażenia PRV podzielono na trzy odrębne fazy:
- Wczesne wejście żywiciela, początkowa replikacja bez rozpoznania żywiciela i ogólnoustrojowe rozprzestrzenianie się wirusa do komórek krwi.
- Ten etap określa ogólny przebieg i ogólne nasilenie zakażenia we wczesnej fazie replikacji MRV. Aby zainicjować infekcję, wszystkie trzy genotypy PRV celują w erytrocyty żywiciela. Jednakże inkluzje wirusowe w erytrocytach i nie stwierdzono, aby w tym okresie doszło do ogólnoustrojowego rozpoznania wirusa przez komórki gospodarza, co wskazuje, że wirus przenika do środowiska w niewielkim stopniu i że istnieje możliwe opóźnienie w replikacji lub zakażeniu różnych komórek typów ma początkowo miejsce.
- Ten etap określa ogólny przebieg i ogólne nasilenie zakażenia we wczesnej fazie replikacji MRV. Aby zainicjować infekcję, wszystkie trzy genotypy PRV celują w erytrocyty żywiciela. Jednakże inkluzje wirusowe w erytrocytach i nie stwierdzono, aby w tym okresie doszło do ogólnoustrojowego rozpoznania wirusa przez komórki gospodarza, co wskazuje, że wirus przenika do środowiska w niewielkim stopniu i że istnieje możliwe opóźnienie w replikacji lub zakażeniu różnych komórek typów ma początkowo miejsce.
- Następnie następuje szczytowa replikacja systemowa, rozpoznawanie gospodarza zależne od obciążenia i tworzenie inkluzji wirusa cytoplazmatycznego.
- W tej fazie ogólnoustrojowe stężenie RNA PRV we krwi występuje najwyższe. Na tym etapie następuje również znaczne wydalanie wirusa, o czym świadczą wcześniejsze wyzwania związane ze wspólnym pożyciem. , że utworzone cytoplazmatyczne wtręty wirusowe, charakterystyczne dla Orthoreovirus , są podobne do tych, które powstają podczas infekcji reowirusem ssaczym dominujących linii komórkowych.
- W tej fazie ogólnoustrojowe stężenie RNA PRV we krwi występuje najwyższe. Na tym etapie następuje również znaczne wydalanie wirusa, o czym świadczą wcześniejsze wyzwania związane ze wspólnym pożyciem. , że utworzone cytoplazmatyczne wtręty wirusowe, charakterystyczne dla Orthoreovirus , są podobne do tych, które powstają podczas infekcji reowirusem ssaczym dominujących linii komórkowych.
- Występuje długotrwała, wysoka trwałość wirusa z ograniczoną replikacją, z możliwością niewielkiego zapalenia serca.
- Czas trwania tej trwałości różni się w zależności od genotypu żywiciela i/lub PRV. Występuje niewielkie lub żadne ogólnoustrojowe rozpoznanie PRV przez gospodarza, a wtręty wirusowe w erytrocytach znikają. cytoplazmie zakażonych erytrocytów nadal występuje umiarkowana ilość zakaźnego PRV , jednakże jest ona w stanie zredukowanym lub niereplikacyjnym. Wydalanie wirusa jest minimalne i z czasem może całkowicie ustać.
- Zapalenie serca może wystąpić na początku tej fazy, bezpośrednio po szczytowym mianie wirusa lub w szczycie infekcji. W zależności od wielu czynników zapalenie to może trwać miesiącami, ale może zniknąć, nawet jeśli nadal utrzymuje się infekcja PRV.
Określenie możliwych skutków zakażenia PRV wiąże się z komplikacjami. Wykazano, że każdy genotyp prowadzi do chorób układu krążenia; jednakże zakażenia PRV przy dużym obciążeniu wystąpiły także u zdrowych łososi i pstrągów.
Choroba
PRV i HSMI
Chociaż norweskie szczepy PRV doprowadziły do ognisk HSMI, nie jest pewne, czy HSMI rozwinie się w wyniku zakażenia północnoamerykańskimi szczepami PRV, ponieważ stwierdzono, że różne łososie i pstrągi mają wykrywalne infekcje PRV pomimo widocznego braku HSMI.
Badania przeprowadzone w Norwegii wykazały, że wstrzyknięcie tkanki ryby wykazującej HSMI zdrowym rybom prowadzi do HSMI, ale ten związek przyczynowy wydaje się trudniejszy do wykazania w przypadku wariantów PRV znalezionych u zachodniego wybrzeża Kanady. Jak dotąd jedynie w przypadku łososia atlantyckiego w Norwegii udowodniono związek przyczynowy, natomiast w innych przypadkach stwierdzono korelację z chorobą, ale związek przyczynowy nie został jeszcze udowodniony. Dziki łosoś z Kolumbii Brytyjskiej, taki jak Coho, Chinook i Sockeye, jest podatny na infekcję PRV i wykazuje podobne miano wirusa do hodowlanego łososia atlantyckiego, ale nie zgłoszono, że wykazuje objawy HSMI.
Zapobieganie chorobom
HSMI jest jedną z najważniejszych chorób w akwakulturze łososia atlantyckiego w Norwegii. W celu złagodzenia tej choroby podjęto próby opracowania szczepionek ukierunkowanych na PRV-1 przy użyciu dezaktywowanych cząstek wirusa i DNA kodującego białka o sekwencjach pochodzących z PRV; żadne leczenie nie zapobiegło zakażeniu PRV, ale skutki HSMI były zmniejszone w przypadku obu terapii. W celu zmniejszenia nasilenia HSMI wypróbowano różne preparaty dietetyczne i podjęto pewne wysiłki, aby wybrać ryby z wariantami genetycznymi nadającymi odporność.
Jedną z metod zapobiegania chorobom może być dezynfekcja powierzchni ikry rybiej przed wprowadzeniem na fermę, ponieważ usunięcie PRV z systemu zamkniętego po fakcie wymaga rygorystycznej dezynfekcji, pozostawienia systemu wolnego od żywicieli i dokładnych, regularnych testów.
Występowanie w akwakulturze
Stwierdzono, że PRV występuje najczęściej w Europie i obu Amerykach, przy stosunkowo niewielkiej liczbie doniesień w Azji. Częstość występowania PRV różni się znacznie w zależności od regionu i gatunku żywiciela. Nadzór PRV występuje najbardziej w Ameryce Północnej i Norwegii
Europa:
PRV-1 występuje w norweskim łososiu atlantyckim hodowlanym od mniej więcej 1988 roku; Podejrzewa się, że w pozostałej części Europy PRV jest zjawiskiem powszechnym, lecz w niektórych krajach liczba raportów jest ograniczona. Islandia zgłosiła dużą częstość występowania PRV-1 u łososia atlantyckiego. W 2018 r. PRV-3 zgłoszono na fermach pstrąga potokowego i tęczowego w Danii i Niemczech.
Ameryka północna:
Wydaje się, że PRV wykazuje wysoką zakaźność w Ameryce Północnej, gdzie pojedyncza zakażona ryba często powoduje zakażenie całego stada ryb w gospodarstwie. PRV-1 jest zwykle wykrywany po powrocie łososia hodowlanego z wody morskiej. Jest prawdopodobne, że PRV-1 występuje w Ameryce Północnej od dziesięcioleci, a być może i dłużej.
Ameryka Południowa:
W Chile hodowlany łosoś atlantycki wykazuje wysoki wskaźnik infekcji PRV-1, podczas gdy populacje dzikich ryb wykazują niski wskaźnik infekcji. Pstrąg tęczowy wykazuje wysoki wskaźnik infekcji PRV-1.
Azja:
W Azji PRV-2 wykryto jedynie w Japonii i powiązano go z zespołem ciałek wtrętowych erytrocytów (EIBS) u hodowlanego łososia Coho.
Zakres hostów
PRV stwierdzono u wielu gatunków zwierząt hodowlanych i dzikich, takich jak:
- Pstrąg pospolity ( Oncorhynchus clarkii )
- Łosoś Chinook ( Oncorhynchus tshawytscha )
- Łosoś sockeye ( Oncorhynchus nerka )
- Pstrąg tęczowy ( Oncorhynchus mykiss )
- Łosoś Coho ( Oncorhynchus kisutch )
- Łosoś Chum ( Oncorhynchus keta )
- Różowy łosoś ( Oncorhynchus gorbusca )
- Łosoś Atlantycki ( Salmo salar )
- Troć wędrowna ( Salmo trutta )
- Wielka stynia srebrna ( silus argentyński )
- Makrela atlantycka ( Trachurus trachurus )
- Śledź atlantycki ( Clupea harengus )
- Gromadnik ( Malotus villosus )
- ^ a b c d e f g h i j k Palacios G, Lovoll M, Tengs T, Hornig M, Hutchison S, Hui J i in. (lipiec 2010). „Zapalenie serca i mięśni szkieletowych łososia hodowlanego jest związane z zakażeniem nowym reowirusem” . PLOS JEDEN . 5 (7): e11487. doi : 10.1371/journal.pone.0011487 . PMC 2901333 . PMID 20634888 .
- ^ abc Takano T, Nawata A, Sakai T, Matsuyama T, Ito T , Kurita J i in. (27.10.2016). „Sekwencjonowanie pełnego genomu i potwierdzenie czynnika sprawczego zespołu ciałek inkluzyjnych erytrocytarnych u łososia Coho identyfikuje nowy typ ortoreowirusa ryb” . PLOS JEDEN . 11 (10): e0165424. doi : 10.1371/journal.pone.0165424 . PMC 5082797 . PMID 27788206 .
- ^ ab Garseth ÅH, Ekrem T , Biering E (11.12.2013). „Filogenetyczne dowody rozprzestrzeniania się i przenoszenia na duże odległości reowirusa ryb (PRV) między hodowlanym i dzikim łososiem atlantyckim” . PLOS JEDEN . 8 (12): e82202. doi : 10.1371/journal.pone.0082202 . PMC 3859594 . PMID 24349221 .
- ^ a b Cartagena J, Jiménez C, Spencer E (listopad 2020). „Wykrywanie ortoreowirusów ryb (PRV-1b i PRV-3a) u hodowlanego łososia Coho z zespołem żółtaczki z Chile”. Akwakultura . 528 : 735480. doi : 10.1016/j.aquaculture.2020.735480 . ISSN 0044-8486 . S2CID 219465755 .
- ^ Zhang Y, Poliński poseł, Morrison PR, Brauner CJ, Farrell AP, Garver KA (2019). „Infekcje reowirusami o dużym obciążeniu nie oznaczają upośledzenia fizjologicznego u łososia” . Granice w fizjologii . 10 : 114. doi : 10.3389/fphys.2019.00114 . PMC 6425399 . PMID 30930782 .
- ^ Noakes DJ, Beamish RJ, Kent ML (marzec 2000). „O spadku liczebności łososia pacyficznego i spekulacyjnych powiązaniach z hodowlą łososia w Kolumbii Brytyjskiej”. Akwakultura . 183 (3–4): 363–386. doi : 10.1016/s0044-8486(99)00294-x . ISSN 0044-8486 .
- Bibliografia _ _ talk.ictvonline.org . Źródło 2021-03-16 .
- ^ a b c d e f Kibenge MJ, Iwamoto T, Wang Y, Morton A, Godoy MG, Kibenge FS (lipiec 2013). „Analiza całego genomu reowirusa ryb (PRV) pokazuje, że PRV reprezentuje nowy rodzaj w rodzinie Reoviridae, a jego sekwencje segmentu genomu S1 grupują go w dwa oddzielne podgenotypy” . Dziennik wirusologiczny . 10 (1): 230. doi : 10.1186/1743-422X-10-230 . PMC 3711887 . PMID 23844948 .
- ^ a b c d Key T, czytaj J, Nibert ML, Duncan R (maj 2013). „Reowirus rybiny koduje cytotoksyczne, niefuzogenne, integralne białko błonowe i wcześniej nierozpoznane białka zewnętrznego kapsydu wirionu” . Journal of General Virology . 94 (pkt 5): 1039–1050. doi : 10.1099/vir.0.048637-0 . PMID 23343626 .
- ^ a b c d e f g h i j k Markussen T, Dahle MK, Tengs T, Løvoll M, Finstad ØW, Wiik-Nielsen CR i in. (2013-07-29). „Analiza sekwencji genomu ortoreowirusa ryb (PRV) związanego z zapaleniem serca i mięśni szkieletowych (HSMI) u łososia atlantyckiego (Salmo salar)” . PLOS JEDEN . 8 (7): e70075. doi : 10.1371/journal.pone.0070075 . PMC 3726481 . PMID 23922911 .
- ^ a b Attoui H, Fang Q, Jaafar FM, Cantaloube JF, Biagini P, de Micco P, de Lamballerie X (sierpień 2002). „Wspólne ewolucyjne pochodzenie aquareowirusów i ortoreowirusów ujawnione przez charakterystykę genomu reowirusa złotego połysku, reowirusa karpia, reowirusa okonia pręgowanego i reowirusa złocistego (rodzaj Aquareovirus, rodzina Reoviridae)” . Journal of General Virology . 83 (cz. 8): 1941–1951. doi : 10.1099/0022-1317-83-8-1941 . PMID 12124458 .
- ^ Duncan R (sierpień 1999). „Rozległa rozbieżność sekwencji i powiązania filogenetyczne między fuzogennymi i niefuzogennymi ortoreowirusami: propozycja gatunku” . Wirusologia . 260 (2): 316–28. doi : 10.1006/viro.1999.9832 . PMID 10417266 .
- ^ ab Yan X, Parent KN, Goodman RP, Tang J, Shou J , Nibert ML i in. (sierpień 2011). „Struktura wirionu reowirusa pawiana, fuzogennego ortoreowirusa pozbawionego włókna adhezyjnego” . Dziennik wirusologii . 85 (15): 7483–95. doi : 10.1128/JVI.00729-11 . PMC 3147939 . PMID 21593159 .
- ^ Nibert ML, Duncan R (04.07.2013). „Bioinformatyka najnowszych izolatów aqua- i ortoreowirusów z ryb: ewolucyjny zysk lub utrata białek FAST i błonnika oraz implikacje taksonomiczne” . PLOS JEDEN . 8 (7): e68607. doi : 10.1371/journal.pone.0068607 . PMC 3701659 . PMID 23861926 .
- ^ Haatveit HM, Nyman IB, Markussen T, Wessel Ø, Dahle MK, Rimstad E (styczeń 2016). „Niestrukturalne białko μNS ortoreowirusa ryb (PRV) tworzy wirusowe struktury przypominające fabryki” . Badania weterynaryjne . 47 (1): 5. doi : 10.1186/s13567-015-0302-0 . PMC 4705589 . PMID 26743679 .
- ^ a b Kuehn R, Stoeckle BC, Young M, Popp L, Taeubert JE, Pfaffl MW, Geist J (22.10.2018). „Identyfikacja patogenu związanego z reowirusem ryb w przypadku pstrąga potokowego (Salmo trutta fario) zakażonego zespołem ciemnienia proliferacyjnego (PDS) przy użyciu technologii nowej generacji” . PLOS JEDEN . 13 (10): e0206164. doi : 10.1371/journal.pone.0206164 . PMC 6197672 . PMID 30346982 .
- ^ a b c Godoy M, Medina DA, Suarez R, Valenzuela S, Romero J, Kibenge M i in. (styczeń 2021). „Rozległa analiza filogenetyczna sekwencji genomowych ortoreowirusa ryb pokazuje solidność klasyfikacji podgenotypów” . Patogeny . 10 (1): 41. doi : 10.3390/pathogens10010041 . PMC 7825714 . PMID 33430212 .
- ^ a b c Godoy MG, Kibenge MJ, Wang Y, Suarez R, Leiva C, Vallejos F, Kibenge FS (czerwiec 2016). „Pierwszy opis klinicznej prezentacji zakażeń ortoreowirusem ryb (PRV) w akwakulturze łososiowatych w Chile i identyfikacja drugiego genotypu (genotypu II) PRV” . Dziennik wirusologiczny . 13 (1): 98. doi : 10.1186/s12985-016-0554-y . PMC 4906990 . PMID 27296722 .
- ^ ab Kibenge FS (luty 2019). „Pojawiające się wirusy w akwakulturze”. Aktualna opinia w wirusologii . Pojawiające się wirusy: przenoszenie wewnątrzgatunkowe • Immunologia wirusowa. 34 : 97–103. doi : 10.1016/j.coviro.2018.12.008 . PMID 30711892 . S2CID 73415392 .
- ^ Di Cicco E, Ferguson HW, Kaukinen KH, Schulze AD, Li S, Tabata A i in. (2018-10-01). „Ten sam szczep ortoreowirusa ryb (PRV-1) jest zaangażowany w rozwój różnych, ale powiązanych chorób łososia atlantyckiego i pacyficznego w Kolumbii Brytyjskiej” . FACETY . 3 (1): 599–641. doi : 10.1139/facets-2018-0008 . ISSN 2371-1671 .
- ^ a b c d e f g h i j k l m n o Poliński MP, Vendramin N, Cuenca A, Garver KA (listopad 2020). „Ortoreowirus ryb: biologia i dystrybucja u ryb hodowlanych i dzikich” . Journal of Fish Diseases . 43 (11): 1331–1352. doi : 10.1111/jfd.13228 . PMID 32935367 .
- ^ Vendramin N, Kannimuthu D, Olsen AB, Cuenca A, Teige LH, Wessel Ø i in. (luty 2019). „Ortoreowirus rybny podtyp 3 (PRV-3) powoduje zapalenie serca u pstrąga tęczowego (Oncorhynchus mykiss)” . Badania weterynaryjne . 50 (1): 14. doi : 10.1186/s13567-019-0632-4 . PMC 6380033 . PMID 30777130 .
- ^ a b Dhamotharan K, Vendramin N, Markussen T, Wessel Ø, Cuenca A, Nyman IB i in. (kwiecień 2018). „Molekularna i antygenowa charakterystyka ortoreowirusa ryb (PRV) z pstrąga tęczowego (Oncorhynchus mykiss)” . Wirusy . 10 (4): 170. doi : 10.3390/v10040170 . PMC 5923464 . PMID 29614838 .
- ^ a b Wessel Ø, Braaen S, Alarcon M, Haatveit H, Roos N, Markussen T i in. (25.08.2017). „Zakażenie oczyszczonym ortoreowirusem Piscine wykazuje związek przyczynowy z zapaleniem serca i mięśni szkieletowych u łososia atlantyckiego” . PLOS JEDEN . 12 (8): e0183781. doi : 10.1371/journal.pone.0183781 . PMC 5571969 . PMID 28841684 .
- ^ Zhou ZH, Zhang H, Jakana J, Lu XY, Zhang JQ (czerwiec 2003). „Struktura wirusa poliedrozy cytoplazmatycznej przy 8 A metodą kriomikroskopii elektronowej: podstawy strukturalne stabilności kapsydu i regulacji przetwarzania mRNA” . Struktura . 11 (6): 651–63. doi : 10.1016/s0969-2126(03)00091-1 . PMID 12791254 .
- ^ Miyazaki N, Uehara-Ichiki T, Xing L, Bergman L, Higashiura A, Nakagawa A i in. (listopad 2008). „Ewolucja strukturalna reoviridae ujawniona przez oryzawirusa w zdobywaniu drugiej powłoki kapsydu” . Dziennik wirusologii . 82 (22): 11344–53. doi : 10.1128/JVI.02375-07 . PMC 2573255 . PMID 18787002 .
- ^ Wiik-Nielsen CR, Løvoll M, Sandlund N, Faller R, Wiik-Nielsen J, Bang Jensen B (styczeń 2012). „Pierwsze wykrycie reowirusa ryb (PRV) u gatunków ryb morskich” . Choroby organizmów wodnych . 97 (3): 255–8. doi : 10.3354/dao02425 . PMID 22422096 .
- ^ Siah A, Morrison DB, Fringuelli E, Savage P, Richmond Z, Johns R i in. (2015-11-04). „Reowirus rybi: genomowa i molekularna analiza filogenetyczna z hodowlanych i dzikich łososiowatych zebranych na wybrzeżu Pacyfiku w Kanadzie i USA” . PLOS JEDEN . 10 (11): e0141475. doi : 10.1371/journal.pone.0141475 . PMC 4633109 . PMID 26536673 .
- ^ a b c Poliński poseł, Marty GD, Snyman HN, Garver KA (marzec 2019). „Ortoreowirus rybi wykazuje wysoką zakaźność, ale niską zjadliwość u łososia atlantyckiego w Kanadzie na Pacyfiku” . Raporty naukowe . 9 (1): 3297. doi : 10.1038/s41598-019-40025-7 . PMC 6416343 . PMID 30867461 .
- ^ Wessel Ø, Olsen CM, Rimstad E, Dahle MK (marzec 2015). „Ortoreowirus rybi (PRV) replikuje się ex vivo w erytrocytach łososia atlantyckiego (Salmo salar L.)” . Badania weterynaryjne . 46 (1): 26. doi : 10.1186/s13567-015-0154-7 . PMC 4350956 . PMID 25888832 .
- ^ Haatveit HM, Wessel Ø, Markussen T, Lund M, Thiede B, Nyman IB i in. (marzec 2017). „Kinetyka białek wirusowych infekcji ortoreowirusem ryb w komórkach krwi łososia atlantyckiego” . Wirusy . 9 (3): 49. doi : 10.3390/v9030049 . PMC 5371804 . PMID 28335455 .
- ^ a b Garver KA, Johnson SC, Poliński MP, Bradshaw JC, Marty GD, Snyman HN i in. (styczeń 2016). „Ortoreowirus ryb z zachodniej części Ameryki Północnej przenosi się na łososia atlantyckiego i łososia skarpetkowego, ale nie powoduje zapalenia serca i mięśni szkieletowych” . PLOS JEDEN . 11 (1): e0146229. doi : 10.1371/journal.pone.0146229 . PMC 4701501 . PMID 26730591 .
- ^ a b c Rząd Kanady, Kanada ds. Rybołówstwa i Oceanów (03.04.2018). „Ortoreowirus rybi (PRV) i zapalenie serca i mięśni szkieletowych (HSMI)” . www.dfo-mpo.gc.ca . Źródło 2021-03-13 .
- ^ Garver, Kyle A.; Johnson, Stewart C.; Poliński, Marek P.; Bradshaw, Julia C.; Marty, Gary D.; Snyman, Heindrich N.; Morrison, Diane B.; Richard, Jon (05.01.2016). „Ortoreowirus ryb z zachodniej części Ameryki Północnej przenosi się na łososia atlantyckiego i łososia skarpetkowego, ale nie powoduje zapalenia serca i mięśni szkieletowych” . PLOS JEDEN . 11 (1): e0146229. doi : 10.1371/journal.pone.0146229 . ISSN 1932-6203 . PMID 26730591 .
- ^ Purcell, MK; Uprawnienia, RL; Evered, J.; Kerwina, J.; Meyers, TR; Stewarta, B.; Winton, JR (luty 2018). „Badania molekularne dorosłego łososia pacyficznego i pstrąga (Oncorhynchus spp.) na obecność kilku wirusów RNA wykazują szerokie rozpowszechnienie ortoreowirusa ryb na Alasce i Waszyngtonie” . Journal of Fish Diseases . 41 (2): 347–355. doi : 10.1111/jfd.12740 .



