Pleksopatia lędźwiowa wywołana promieniowaniem
| Nerwy lędźwiowo-krzyżowe | |
|---|---|
 Splot lędźwiowy i jego gałęzie
| |
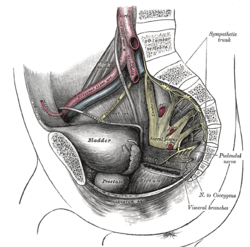 Rozwarstwienie miednicy z widocznymi splotami krzyżowymi i sromowymi
| |
| Anatomiczne warunki neuroanatomii |
Pleksopatia lędźwiowa wywołana promieniowaniem (RILP) lub pleksopatia lędźwiowo-krzyżowa wywołana promieniowaniem (RILP) to uszkodzenie nerwów w miednicy i dolnej części kręgosłupa spowodowane radioterapią. RILP jest rzadkim skutkiem ubocznym radioterapii wiązkami zewnętrznymi oraz implantów radiacyjnych brachyterapii śródmiąższowej i wewnątrzjamowej .
Ogólnie rzecz biorąc, takie uszkodzenie nerwów może objawiać się etapami, wcześniej jako demielinizacja , a później jako powikłania przewlekłego włóknienia popromiennego . RILP występuje w wyniku radioterapii stosowanej w leczeniu chłoniaka lub nowotworów w obrębie jamy brzusznej lub miednicy, takich jak rak szyjki macicy, jajników, pęcherza moczowego, okrężnicy, nerek, trzustki, prostaty, jąder, jelita grubego, okrężnicy, odbytnicy lub odbytu . Obszar splotu lędźwiowo-krzyżowego jest radiowrażliwy i pleksopatia popromienna może wystąpić po ekspozycji na średnie lub maksymalne poziomy promieniowania 50-60 Gray z istotną różnicą szybkości odnotowaną w tym zakresie.
Symptomy i objawy
Pleksopatia lędźwiowo-krzyżowa charakteryzuje się jednym z następujących objawów; zwykle dwustronne i symetryczne, chociaż znana jest jednostronność.
- Zaburzenia czucia kończyn dolnych , nieprawidłowe odczucia dotyku lub czucia
- Osłabienie kończyn dolnych
- Drętwienie kończyn dolnych
- Parestezje kończyn dolnych, np. opadanie stopy , zanik mięśni
- Ból kończyn dolnych
Objawy są zazwyczaj stopniowe, z okresami stabilizacji pomiędzy nimi, osłabienie często pojawia się wiele lat później. Osłabienie często występuje w grupach mięśni dolnej części nogi. Objawy są zwykle nieodwracalne.
Pierwsze objawy mogą wystąpić już po 2-3 miesiącach od radioterapii. Mediana początku wynosi około 5 lat, ale może być bardzo zmienna, 2-3 dekady po radioterapii. W jednym studium przypadku odnotowano początkowy początek występujący 31 lat po leczeniu.
Przyczyna
Promieniowanie jonizujące stosowane w leczeniu jest mechanizmem aktywacji apoptozy (śmierci komórek) w obrębie docelowego raka, ale może również wpływać na pobliskie zdrowe tkanki wrażliwe na promieniowanie, takie jak splot lędźwiowo-krzyżowy . Występowanie i nasilenie RILP jest związane z wielkością promieniowania jonizującego , a wrażliwość nerwów obwodowych na promieniowanie może ulec dalszemu pogorszeniu w przypadku połączenia z chemioterapią, taką jak taksany i leki platynowe, podczas leczenia.
Patofizjologia
Patofizjologiczny proces leżący u podstaw uszkodzenia nerwów RILP przez promieniowanie jest omawiany od lat 60. XX wieku i nadal nie ma dokładnej definicji. Istnieje zgoda co do progresji objawów RILP, ze stopniowaniem (opóźnieniem czasowym) między dwoma okresami początku pleksopatii, pierwszym z powodu uszkodzenia popromiennego, a drugim z powodu zwłóknienia. Proponowane mechanizmy wczesnego uszkodzenia nerwów obejmują uszkodzenie mikrokrążenia ( niedokrwienie ) zaopatrujące mielinę, uszkodzenie mieliny przez promieniowanie oraz uszkodzenie komórek wolnych rodników tlenowych. Opóźnione uszkodzenie nerwów przypisuje się neuropatii uciskowej oraz późne niedokrwienie włóknisto-zanikowe spowodowane retraktywnym zwłóknieniem.
Diagnoza
Bardziej powszechnym źródłem pleksopatii lędźwiowej jest bezpośrednie lub wtórne zajęcie splotu przez guz, przy czym MRI jest typowym narzędziem potwierdzającym. Guzy zazwyczaj objawiają się wzmocnieniem korzeni nerwowych i hiperintensywnością T2-zależną. Rozważenie różnicowe RILP wymaga zebrania wywiadu medycznego i badania neurologicznego.
Objawy neurologiczne RILP mogą naśladować inne zaburzenia nerwowe. Ludzie mogą prezentować czysty zespół dolnego neuronu ruchowego, objaw stwardnienia zanikowego bocznego (ALS) . RILP może być również błędnie diagnozowany jako przerzut do opon mózgowo-rdzeniowych , często wykazujący guzkowe wzmocnienie korzeni nerwowych ogona końskiego w rezonansie magnetycznym lub zwiększoną zawartość białka w płynie mózgowo-rdzeniowym .
Inne rozpoznania różnicowe, które należy wziąć pod uwagę, to przewlekła zapalna poliradikuloneuropatia demielinizacyjna , nowotworowa pleksopatia lędźwiowo-krzyżowa , neuronopatia paranowotworowa , cukrzycowa pleksopatia lędźwiowo- krzyżowa , choroba zwyrodnieniowa dysku ( osteoporoza kręgosłupa ), choroba zwyrodnieniowa kręgosłupa , zwężenie kręgosłupa lędźwiowego , pleksopatia poinfekcyjna, rakowe zapalenie opon mózgowo-rdzeniowych (CM) ) , mononeuritis multiplex i pleksopatia indukowana chemioterapią .
Testy mające na celu ustalenie rozpoznania RILP obejmują analizę surowicy krwi , zdjęcia rentgenowskie , EMG , MRI i analizę płynu mózgowo-rdzeniowego .
Zapobieganie
Ponieważ zmiany neurologiczne RILP są zazwyczaj nieodwracalne, a strategia leczenia nie została jeszcze zdefiniowana, najlepszym podejściem jest zapobieganie. Leczenie raka pierwotnego pozostaje oczywistym wymogiem, ale niższe dawki promieniowania splotu lędźwiowego zminimalizują lub wyeliminują RILP.
Jedną z metod zmniejszenia dawkowania splotu lędźwiowo-krzyżowego jest włączenie go do innych zagrożonych narządów, które zostają oszczędzone przed promieniowaniem.
Kluczem do profilaktyki jest rozwiązanie problemu braku dowodów klinicznych między radioterapią a wystąpieniem problemów neurologicznych. Związek ten jest ukryty przez niski wskaźnik toksyczności RILP, brak dużej monitorowanej populacji i brak gromadzenia danych w wielu instytucjach.
Kierownictwo
Leczenie RILP jest przede wszystkim wspomagające w aspekcie psychicznym, fizjologicznym i społecznym oraz uwzględnia wszelkie obciążające (synergiczne) czynniki neurologiczne.
Aby zapobiec nasilaniu się istniejących objawów RILP i zminimalizować dalszy postęp
- Usuń czynniki współistniejące
- kontrolować cukrzycę i nadciśnienie
- unikać nadmiernego spożywania alkoholu
- unikając miejscowego urazu w napromieniowanej objętości
- opanowanie ostrego obrzęku
- kontrolować ostre stany zapalne. Farmaceutyki, które mogą być skuteczne, to kortykosteroidy (deksametazon)
- unikaj rozciągania splotu unieruchomionego przez zwłóknienie, np. przenoszenia dużych ciężarów lub wykonywania rozległych ruchów, które mogą spowodować nagłą dekompensację neurologiczną .
Wpływ na osobę z tym schorzeniem zależy od rodzaju upośledzenia. Upośledzenia mogą obejmować wyzwania fizyczne, dysfunkcje jelit i/lub pęcherza moczowego i mogą wystąpić w wielu sytuacjach w pracy iw domu. Fizjoterapia i terapia zajęciowa są ważnymi elementami w utrzymaniu mobilności i używania kończyn dolnych, wraz z pomocniczymi środkami pomocniczymi, takimi jak ortezy stawu skokowego i stopy (AFO) , laska, chodziki itp. Techniki reedukacji sensorycznej mogą być konieczne dla zachowania równowagi, a leczenie obrzęku limfatycznego może być potrzebnym.
bólu neuropatycznym RILP, to
- trójpierścieniowe leki przeciwdepresyjne (TCA) (amitryptylina)
- Leki przeciwpadaczkowe lub przeciwdrgawkowe (gabapentyna, pregabalina, karbamazepina, kwas walproinowy)
- Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) (duloksetyna) w celu utrzymania prawidłowego poziomu norepinefryny i serotoniny
- Leki przeciwbólowe (pregabalina, metadon)
- Opiaty można stosować pojedynczo lub w celu nasilenia jednoczesnego stosowania TCA.
- Leki przeciwarytmiczne (meksylityna) na sztywność mięśni
Niefarmaceutyczne względy RILP są
- akupunktura na ból
- masaż na ból
- przezskórna elektryczna stymulacja nerwów (TENS) przeciwbólowa
- Benzodiazepiny mogą być stosowane do parestezji
- chininę można stosować na skurcze
Upośledzenie funkcjonalne i resztkowy ból mogą prowadzić do izolacji społecznej. Grupy wsparcia osób chorych na raka są cennym źródłem wiedzy o zespole i możliwościach terapeutycznych, a także sposobem wyrażania emocji związanych z chorobą nowotworową i przetrwaniem go.
Wyniki
Wraz ze wzrostem wskaźników przeżywalności leczenia raka jakość życia osób, które przeżyły, stała się priorytetem zdrowia publicznego. Skutki RILP mogą być wyniszczające. Bez skutecznego leczenia kontrolującego postępującą naturę uszkodzenia popromiennego prawdopodobnym skutkiem jest dysfunkcja kończyn.
Wynik uszkodzeń spowodowanych promieniowaniem jest związany z początkowym czasem ich wystąpienia.
- Ostre objawy, pojawiające się w ciągu pierwszych kilku dni, mają najkorzystniejsze skutki i prawdopodobnie ustępują w ciągu kilku tygodni.
- Wczesne objawy opóźnione, pojawiające się w ciągu pierwszych miesięcy, zazwyczaj obejmują mielopatię . Te problemy często ustępują bez leczenia.
- Późno opóźnione objawy, pojawiające się kilka miesięcy lub lat po leczeniu, mogą również obejmować mielopatię, ale jej nasilenie jest bardziej prawdopodobne, co prowadzi do trwałego porażenia. Typowa jest znaczna zachorowalność neurologiczna, z bardzo powolną rekonwalescencją neurologiczną.
Epidemiologia
Dokładna częstość występowania nie została ustalona. Literatura na ten temat jest skąpa. Kliniczne przypadki RILP są rzadkie i dotyczą od 0,3 do 1,3% osób leczonych promieniowaniem jamy brzusznej lub miednicy. Częstość występowania jest zmienna i zależy od strefy napromieniania, poziomu dawki i sposobu podawania. Na przykład, gdy porównano alternatywne poziomy dawkowania, zaobserwowano wyższe szybkości, od 12 do 23%, przy czym wyższe szybkości RILP występowały przy wyższych dawkach.
Historia
Od 1977 r. rzadko opisywano neuropatię lędźwiowo-krzyżową wynikającą z radioterapii . Jeden z najwcześniejszych przypadków miał miejsce w 1948 roku.
Wykazano, że częstość występowania neuropatii obwodowej zmniejsza się, gdy stosuje się niższe terapeutyczne dawki promieniowania. Podobne uszkodzenie nerwu, pleksopatia ramienna wywołana promieniowaniem (RIBP) , może wystąpić wtórnie do radioterapii piersi. Badania nad RIBP obserwowały splot ramienny radioczulość. Uraz obserwowano po podaniu dawki 40 Gy w 20 frakcjach, a RIBP istotnie wzrastał przy dawkach większych niż 2 Gy na frakcję. RIBP występuje częściej niż radikulopleksopatia lędźwiowo-krzyżowa i ma historię kliniczną ze zmniejszonymi poziomami dawkowania. Częstość występowania RIBP wynosiła 60% w latach 60. XX wieku, kiedy zastosowano 60 zabiegów Graya w 5 frakcjach Graya ; Występowanie RIBP w 2010 roku zbliża się do 1% przy zastosowaniu 50 zabiegów Graya we frakcjach 3 Gy.
Częstość występowania RILP szacuje się na 0,3% do 1,3%, chociaż rzeczywista częstość jest prawdopodobnie wyższa. Uszkodzenie tkanki miękkiej prowadzące do RILP jest częściej obserwowane przy poziomach ekspozycji powyżej 50 Gy, chociaż miało miejsce już przy dawce 30 Gy. Głównym krokiem w kierunku zmniejszenia częstości występowania RILP jest ograniczenie poziomu dawkowania splotu lędźwiowo-krzyżowego podczas leczenia nowotworów miednicy mniejszej, ograniczając średnią dawkę do < 45 Gy. Jedno podejście do obniżonych poziomów, mapowanie splotu z innymi zagrożonymi narządami, zostało ocenione klinicznie w 2010 roku.
Dowody kliniczne dotyczące związku przyczynowo-skutkowego w profilaktyce i leczeniu polineuropatii wywołanej promieniowaniem są ograniczone.
W 2011 r. Radiation Oncology Institute (ROI) ogłosił utworzenie Narodowego Rejestru Onkologii Radiacyjnej (NROR). ROI i Massachusetts General Hospital początkowo skupiłyby się na NROR na raku prostaty, zbierając informacje o skuteczności i skutkach ubocznych (takich jak neuropatia wywołana promieniowaniem, RILP) od osób leczonych radioterapią. W 2013 roku Amerykańskie Towarzystwo Radioterapii Onkologicznej (ASTRO) przyłączył się do wysiłków, a liczba miejsc gromadzenia danych wzrosła do 30 w ramach rocznego projektu pilotażowego. Pojawiły się pułapki gromadzenia danych medycznych, ponieważ tylko 14 witryn było w stanie dostarczyć dane, a wszystkie wymagały znacznych nakładów pracy przy ręcznym wprowadzaniu danych. Pierwszym wnioskiem projektu NROR było stwierdzenie, że przyszłe rejestry będą musiały radzić sobie z analizą dużych zbiorów danych . W 2015 roku ASTRO, National Cancer Institute i American Association of Physicists in Medicine sponsorowały warsztaty Big Data w National Institutes of Health.
Badania
Eksperymentalne podejścia do leczenia RILP obejmują:
- Tlen hiperbaryczny (HBO) miał mieszane wyniki, niektóre badania wykazały korzyści, inne nie.
- Terapia przeciwzakrzepowa (warfin, heparyna) została wypróbowana w przypadku niedokrwienia i odbudowy naczyń włosowatych, niektóre bez wyraźnych korzyści, inne z poprawą funkcji motorycznych.
- Terapia PENTOCLO- połączenie Pentoksyfiliny (PTX) , witaminy E i klodronianu , bisfosfanianu; PTX w stanach zapalnych, witamina E jako wymiatacz wolnych rodników tlenowych, które mogą prowadzić do zwłóknienia, oraz klodronian, który może hamować niszczenie nerwów mielinowych.
- Rozluźnienie mięśniowo-powięziowe może zmniejszyć kompresyjne działanie włókniaków, uwalniając uwięzione nerwy.
Zobacz też
- Zatrucie promieniowaniem
- Radioterapia
- ICD-10-CM Kod Światowej Organizacji Zdrowia G62.82: Polineuropatia wywołana promieniowaniem
- ICD-11-MMS (wersja 2018) Kod 8B92.0 Światowej Organizacji Zdrowia: Popromienna pleksopatia lędźwiowo-krzyżowa
![]() Ten artykuł zawiera tekst należący do domeny publicznej z 20. wydania Gray's Anatomy (1918)
Ten artykuł zawiera tekst należący do domeny publicznej z 20. wydania Gray's Anatomy (1918)