Przegrupowanie diwinylocyklopropano-cykloheptadienu
diwinylocyklopropano -cykloheptadienu jest chemiczną przemianą organiczną, która obejmuje izomeryzację 1,2-diwinylocyklopropanu do cykloheptadienu lub -trienu. Jest koncepcyjnie powiązany z przegrupowaniem Cope'a , ale ma zaletę w postaci silnej termodynamicznej siły napędowej dzięki uwolnieniu naprężenia pierścienia. Ta moc termodynamiczna jest ostatnio rozważana jako alternatywne źródło energii.
Wstęp
W 1960 roku Vogel odkrył, że 1,2-diwinylocyklopropan przegrupowuje się do cykloheptan-1,4-dienu. Po jego odkryciu w latach sześćdziesiątych XX wieku przeprowadzono serię intensywnych badań mechanistycznych reakcji, gdy naukowcy zdali sobie sprawę, że jest ona podobna (zarówno strukturalna, jak i mechanistyczny) do powiązanego przegrupowania winylocyklopropanu do cyklopentenu. W latach siedemdziesiątych XX wieku przegrupowanie osiągnęło użyteczność syntetyczną i do dziś jest użyteczną metodą tworzenia siedmioczłonowych pierścieni. Zgłoszono odmiany zawierające heteroatomy (patrz poniżej).
(1)
Zalety: Będąc przegrupowaniem, proces wykazuje idealną ekonomię atomową. Często przebiega samoistnie, bez potrzeby stosowania katalizatora. Ścieżki konkurencyjne są minimalne dla przegrupowania całkowicie węglowego.
Wady: Konfiguracja materiałów wyjściowych wymaga w wielu przypadkach kontroli — trans -diwinylocyklopropany często wymagają ogrzewania w celu ułatwienia izomeryzacji przed wystąpieniem przegrupowania. Przegrupowania obejmujące heteroatomy mogą wykazywać zmniejszoną wydajność z powodu tworzenia produktów ubocznych.
Mechanizm i stereochemia
Przeważający mechanizm
Podstawowa debata dotycząca mechanizmu przegrupowania koncentruje się na tym, czy jest to proces uzgodniony (sigmatropowy), czy stopniowy (dwurodnikowy). Eksperymenty mechanistyczne wykazały, że trans -diwinylocyklopropany epimeryzują do odpowiednich izomerów cis i przechodzą przegrupowanie najprawdopodobniej na drodze skoordynowanej. Zaproponowano stan przejściowy podobny do łodzi, który pomaga wyjaśnić obserwowaną stereospecyficzność procesu. , czy początkowa epimeryzacja trans zachodzi w procesie jedno- czy dwuośrodkowym. (2)
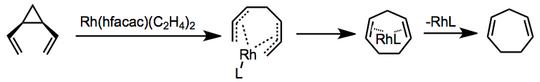
Znane są wersje przegrupowania katalizowane metalami przejściowymi, a mechanizmy są różne. W jednym przykładzie wykorzystującym bis(etyleno)heksafluoroacetyloacetonian rodu, koordynacja i tworzenie kompleksu bis-π-allilu poprzedza zamknięcie pierścienia elektrocyklicznego i uwolnienie katalizatora.
(3)
Warianty stereoselektywne
Reakcje diwinylocyklopropanów zawierających podstawione wiązania podwójne są stereospecyficzne pod względem konfiguracji wiązań podwójnych – izomery cis , cis dają produkty cis , izomery cis , trans dają produkty trans. Zatem chiralne, nieracemiczne materiały wyjściowe dają produkty chiralne bez utraty enancjomerycznej czystości. W poniższym przykładzie w każdym przypadku obserwowano tylko przedstawione izomery.
(4)
Zakres i ograniczenia
Tytułowej reakcji podlega wiele różnych diwinylocyklopropanów. Te prekursory zostały wygenerowane różnymi metodami, w tym dodaniem nukleofili cyklopropylowych (sole litu lub miedzi) do aktywowanych wiązań podwójnych lub potrójnych, eliminacją bis (2-haloetylo) cyklopropanów i cyklopropanacją.
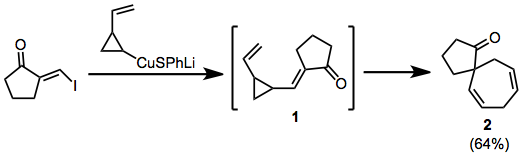
W poniższym przykładzie dodanie-eliminacja miedzianu generuje przejściowy enon 1 , który przestawia się w spirocykl 2 .
(5)
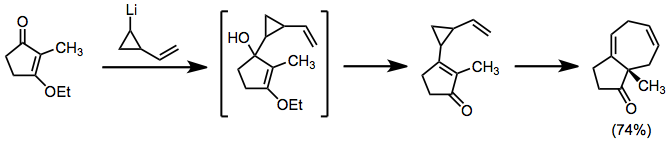
Związki litoorganiczne można wykorzystać w podobnej roli, ale dodać je bezpośrednio do karbonylków. Produkty z wynikiem topologii stopionej.
(6)
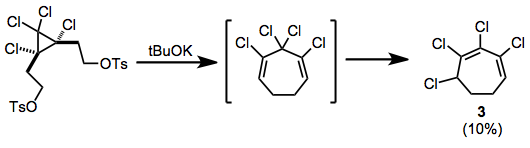
Zaobserwowano przegrupowanie po wyeliminowaniu ditozylanów; tak wytworzony chlorowany cykloheptadien izomeryzuje do sprzężonego heptadienu 3 podczas reakcji.
(7)
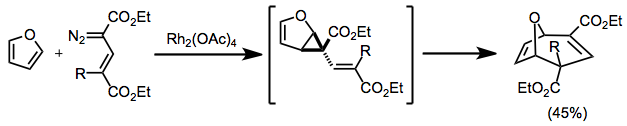
Cyklopropanowanie ze sprzężonymi związkami diazowymi prowadzi do powstania diwinylocyklopropanów, które następnie ulegają przegrupowaniu. Gdy stosowane są cykliczne materiały wyjściowe, powstają produkty mostkowe.
(8)
Reakcji mogą podlegać także substraty zawierające trójczłonowe pierścienie heterocykliczne. cis -diwinylepoksydy dają oksepiny w podwyższonych temperaturach (100 ° C). Izomery trans ulegają interesującemu kompetycyjnemu przegrupowaniu do dihydrofuranów za pośrednictwem ylidu karbonylu, a ten sam pośredni ylid został zaproponowany jako bezpośredni prekursor produktu oksepiny 4 . Sprzężone epoksydy dienylu tworzą podobne produkty, co potwierdza istnienie pośredniego ylidu. (9)
Diwinyloazyrydyny podlegają podobnemu zestawowi reakcji, w wyniku których powstają azepiny lub winylopiroliny , w zależności od względnej konfiguracji materiału wyjściowego azyrydyny. Diwinylotirany mogą dostarczać tiepiny lub dihydrotiofeny, chociaż reakcje te są wolniejsze niż reakcje odpowiednich związków zawierających azot i tlen .
Aplikacje syntetyczne
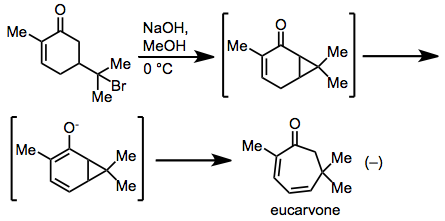
Najwcześniejszej obserwacji cykloheptadienu poprzez tytułowe przegrupowanie dokonał Baeyer w swojej syntezie eukarwonu z bromowodorku karwonu. Badania mechanistyczne ujawniły, że przegrupowanie rzeczywiście przebiegało poprzez skoordynowany mechanizm typu Cope.
(10)
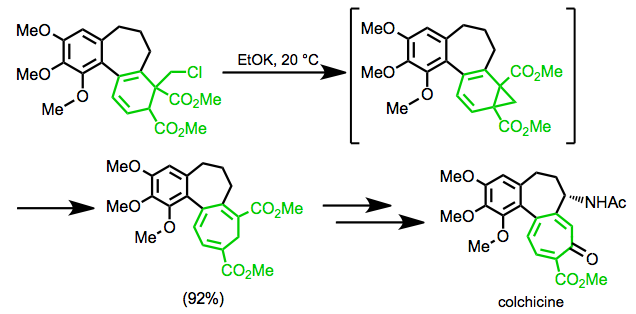
W syntezie kolchicyny Eschenmosera przegrupowanie jest wykorzystywane do utworzenia siedmioczłonowego pierścienia celu.
(11)
Racemiczna synteza syreniny wykorzystuje reakcję Wittiga do utworzenia kluczowego diwinylocyklopropanu. Uwodornianie produktu przegrupowania dało cel.
(12)
Warunki i procedura doświadczalna
Typowe warunki
Zazwyczaj przegrupowanie przeprowadza się tuż po utworzeniu diwinylocyklopropanu, w tym samym naczyniu. Ogrzewanie jest czasami konieczne, szczególnie w przypadku trans , które muszą przejść epimeryzację przed przegrupowaniem. Jednak przy wystarczającej energii do pokonania barier aktywacji izomeryzacja jest zwykle bardzo wydajna.
Przykładowa procedura
(13)
Do zimnego (–78°C) mieszanego roztworu diizopropyloamidku litu (1,4–1,5 mmol/mmol ketonu) w suchym THF (4 ml/mmol zasady) w atmosferze argonu dodano powoli roztwór n-butylo-trans -2-winylocyklopropyloketon (1,19 mmola) w suchym THF (1 ml/mmol ketonu) i otrzymany roztwór mieszano w temperaturze –78°C przez 45 minut. Dodano roztwór świeżo sublimowanego chlorku tert-butylodimetylosililu (1,6 mmol/mmol ketonu) w suchym THF (1 ml/mmol chlorku), a następnie suchy HMPA (0,5 ml/mmol ketonu). Roztwór mieszano w temperaturze –78°C przez 15 minut iw temperaturze pokojowej przez 2–3 godziny, a następnie rozdzielono pomiędzy nasycony wodny roztwór wodorowęglanu sodu i pentan (odpowiednio 10 ml i 20 ml/mmol ketonu). Fazę wodną przemyto dwukrotnie pentanem. Połączone ekstrakty przemyto czterokrotnie nasyconym wodnym roztworem wodorowęglanu sodu i dwukrotnie solanką MgSO4 , a następnie wysuszono ( ). Usunięcie rozpuszczalnika, a następnie destylacja pozostałego oleju typu bulb-to-bulb dała odpowiedni eter sililowo-enolowy w postaci bezbarwnego oleju, który nie wykazywał absorpcji rozciągania karbonylu w podczerwieni. Termolizę eteru sililowo-enolowego przeprowadzono przez ogrzewanie (czysta atmosfera argonu) w temperaturze 230° (temperatura łaźni powietrznej) przez 30–60 minut. Destylacja bezpośrednia (140-150°/12 torr) otrzymanych materiałów dała cykloheptadien z wydajnością 85%: IR (film) 1660, 1260, 840 cm–1; 1H NMR ( CDCI3 ) ) 8 0,09 (s, 6H), 0,88 (s, 9H), 0,7-2,75 (m, 14H), 4,8 (t, 1H, J = 5,5 Hz), 5,5-5,9 (m, 2H .