Regulowany objętościowo kanał anionowy
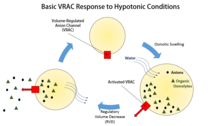
Regulowane objętościowo kanały anionowe ( VRAC ) mają kluczowe znaczenie dla regulacji wielkości komórek poprzez transport jonów chlorkowych i różnych organicznych osmolitów , takich jak tauryna lub glutaminian , przez błonę komórkową i nie jest to jedyna funkcja, z którą te kanały zostały połączone. Niektóre badania sugerują również, że VRAC mogą być również przepuszczalne dla wody.
Regulacja objętości komórek jest konieczna nie tylko jako profilaktyka pęcznienia czy kurczenia się pod wpływem zmian w środowisku komórki, ale także we wszystkich fazach życia komórki. Zmiana objętości komórki, czy to pęcznienie, czy kurczenie się, na ogół zachodzi bez większych zmian, takich jak egzocytarna insercja lub endocytarne pobieranie błony plazmatycznej. Zamiast tego regulacja objętości odbywa się głównie poprzez transport potasu, sodu, chlorków i organicznych osmolitów przez membranę. Konsekwencje braku zdolności komórek do regulowania swojej objętości w stosunku do otoczenia są poważne, ponieważ pęcznienie prowadzi do lizy , a kurczenie się ostatecznie prowadzi od odwodnienia do apoptozy . Specyficzną rolą, jaką odgrywają VRAC w regulacji objętości komórek, jest w szczególności zmniejszanie objętości regulacyjnej (RVD) komórek.
Badania nad VRAC doprowadziły niektórych do wniosku, że są one szeroko eksprymowane w komórkach ssaków i że mogą być nawet wszechobecne. Wykazano również, że VRAC uczestniczą w podstawowych procesach komórkowych innych niż podstawowa regulacja objętości, takich jak , migracja i apoptoza komórek .
Struktura i mechanizm
Chociaż społeczność naukowa wiedziała o VRAC od dawna, dopiero niedawno odkryto, jaki jest skład molekularny kanałów. Składają się z heteromerów białek LRRC8 , których istnieje pięć odmian. Jednak specyficzny skład LRRC8A , LRRC8B , LRRC8C , LRRC8D i LRRC8E niezbędny do prawidłowego funkcjonowania VRAC jest nieznany. Sam LRRC8A może tworzyć heksameryczny VRAC, dla którego struktura cyro-EM została określona w jego mysich i ludzkich wersjach.
Badania wykazały również, że zmiany w składzie podjednostek prowadzą do zmian w zdolności VRAC do transportu niektórych metabolitów . Na przykład podjednostka LRRC8D zaangażowana w skład VRAC jest silnie związana z transportem tauryny wraz z określonymi lekami przeciwnowotworowymi. Dzięki takim eksperymentom wiemy, że jest prawdopodobne, że białka LRRC8 również tworzą pory VRAC.
Jeśli chodzi o mechanizm VRAC, ostatnie badania sugerują, że są one aktywowane, gdy dochodzi do zmniejszenia wewnątrzkomórkowej siły jonowej, co oznacza, że VRAC mogą również działać jako czujniki, a także wpływać na regulację objętości komórki. Jednak naukowcy nie byli w stanie znaleźć żadnych wewnątrzkomórkowych mechanizmów sygnalizacyjnych, które odgrywają dominującą rolę w aktywacji VRAC.
Część przezbłonowa białek LRRC8 jest podobna do tej w panneksynach .
Role w neuronach
VRAC są kluczowe dla transportu nie tylko chlorków, ale także tauryny , glutaminianu i asparaginianu . Te organiczne osmolity są ważne nie tylko dla regulacji objętości komórkowej, ponieważ są również bardzo istotne dla sygnalizacji pozakomórkowej. Aby przygotować grunt pod rolę VRAC w sygnalizacji zewnątrzkomórkowej, musimy omówić pewne konsekwencje, jakie uwalnianie glutaminianu i tauryny z VRAC ma odpowiednio na otaczające neurony .
W przypadku glutaminianu , gdy pobudzające neuroprzekaźniki są uwalniane i aktywują kanały w otaczających neuronach , powoduje to nadaktywną depolaryzację i wzrost jonów wapnia, a ostatecznie apoptozę komórkową . Nazywa się to ogólnie ekscytotoksycznością i zwykle powoduje obrzęk neuronów. Uwalnianie organicznych osmolitów przez VRAC w odpowiedzi na to pęcznienie i napływ jonów najprawdopodobniej pomaga w zapobieganiu neuronowi przed pęknięciem, ponieważ uwalnianie związków nieorganicznych z komórki wiązało się jedynie ze zmniejszeniem objętości komórki o około 20-30%. Jednak oprócz zapobiegania lizie neuronu, uwalnianie tauryny i glutaminianu będzie również nadal propagować efekt ekscytotoksyczności na sąsiednie neurony . Najbardziej odpowiednimi komórkami do zbadania pod kątem roli VRAC i reakcji na ekscytotoksyczność są astrocyty . Wynika to z ich roli jako wspierających komunikację neuronową w mózgu, faktu, że udowodniono, że zawierają VRAC oraz faktu, że znaleziono je w stanie spuchniętym w odpowiedzi na patologie dotyczące ekscytotoksyczności . Jak już powiedzieliśmy, wzrost stymulacji neuronu powoduje ekscytotoksyczność , a glutaminian jest jednym z neuroprzekaźników , które w nadmiarze mogą powodować tę odpowiedź neuronalną. Istnieje wiele patologii przypisywanych tej odpowiedzi komórkowej, w tym udar i hipoglikemia pośród innych. Na przykład kilka badań wykazało, że w astrocytach może być związana ze związanym z udarem wzrostem substancji takich jak ATP . Eksperymenty wykazały, że inhibitory VRAC były w stanie zmniejszyć związane z udarem uwalnianie pobudzających neuroprzekaźników w mózgu; co oznacza, że VRAC są prawdopodobnie aktywowane przez wzrost komórkowego ATP i innych cząsteczek w astrocytach , a uwalnianie glutaminianu przez te komórki powoduje, że neurony wokół nich ulegają depolaryzacji, zwiększają stężenie jonów wapnia i ulegają apoptozie .
Inny organiczny osmolit związany z VRAC, tauryna , również pełni wiele pozakomórkowych funkcji sygnalizacyjnych. W szczególności uważa się, że uwalnianie tauryny z gleju przez VRAC jest powiązane z ogólnoustrojową regulacją objętości w jądrze nadwzrokowym (SON) reagującym na osmos. Początkowo naukowcy myśleli, że neurony znalezione w SON nie są w stanie przejść RVD, ale później odkryto, że ostatecznie po pewnym czasie wytwarzają prąd jonów chlorkowych. Astrocyty ponownie zbadano w odniesieniu do tego odkrycia i odkryli, że komórki łatwo reagują na środowisko hipertoniczne , uwalniając taurynę przez kanały podobne do VRAC. Z kolei tauryna aktywuje kanały chlorkowe receptora glicynowego na sąsiednich neuronach SON, co powoduje ich hiperpolaryzację . Ponieważ neurony SON kurczą się i depolaryzują w hipertonicznym , ta interakcja między astrocytami działa jak inhibitor wydzielania wazopresyny przez SON.
Na podstawie tych badań przeprowadzonych nad rolą VRAC zarówno w warunkach ekscytotoksyczności , jak i regulacji jądra nadwzrokowego (SON) reagującego na osmos, istnieją duże implikacje dla faktycznego wpływu tego kanału na codzienną aktywność neuronów. Jest prawdopodobne, że VRAC odgrywają wiele głównych ról w regulacji neuronów; badaczom trudno jest jednak zawęzić zakres ich działania. Kolejny ważny aspekt neuronów należy pamiętać, że kotransportery potasu i chlorków (KCC) to inne białka, które również są częścią procesu RVD i są aktywowane, gdy komórki ulegają pęcznieniu. Należy o tym pamiętać, ponieważ VRAC nie są jedynymi obecnymi cząsteczkami, które pomagają w regulacji objętości komórek, a ostatnie badania wykazały, że prawdopodobieństwo współpracy tych dwóch kanałów jest wysokie.
Połączenia medyczne
Oprócz powiązań przedstawionych w dyskusji na temat wielu ról VRAC w neuronach , badania wykazały, że kurczenie się komórek w dużej mierze poprzedza śmierć komórki (znaną jako AVD – apoptotyczny spadek objętości). Były też badania, które wykazały, że VRAC odgrywają rolę w tym procesie. Jest prawdopodobne, że hamowanie kurczenia się komórek jest związane z inhibitorami VRAC lub z ogólnym zaburzeniem białek LRRC8. apoptozy wywołanej lekami . Dlatego VRAC mogą odgrywać rolę w lekooporności w niektórych typach raka.