Sialoproteina kości
 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IBSP | |||||||||||||||||||||||||||||||||||||||||||||||
| , BNSP, BSP, BSP-II, SP-II, sialoproteina wiążąca integrynę | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Sialoproteina kostna (BSP) jest składnikiem tkanek zmineralizowanych, takich jak kość , zębina , cement i zwapniała chrząstka . BSP jest istotnym składnikiem macierzy zewnątrzkomórkowej kości i sugeruje się, że stanowi około 8% wszystkich niekolagenowych białek znajdujących się w kości i cemencie. BSP, białko SIBLING , zostało pierwotnie wyizolowane z bydlęcej kości korowej jako glikopeptyd o masie cząsteczkowej 23 kDa i wysokiej zawartości kwasu sialowego .
Ludzki wariant BSP jest nazywany sialoproteiną kości 2, znaną również jako sialoproteina wiążąca komórki lub sialoproteina wiążąca integrynę i jest kodowana przez gen IBSP .
Struktura
Natywny BSP ma pozorną masę cząsteczkową 60-80 kDa w oparciu o SDS-PAGE , co stanowi znaczne odchylenie od przewidywanej masy (w oparciu o sekwencję cDNA ) około 33 kDa. Ssacze cDNA BSP kodują białka o średniej długości 317 aminokwasów, które obejmują 16-resztowy prebiałkowy peptyd sygnałowy sekrecji. Wśród obecnie scharakteryzowanych ssaczych cDNA występuje około 45% zachowania identyczności sekwencji i dalsze 10-23% podstawienia konserwatywnego. Białko jest silnie kwaśne (pKa ~3,9) i zawiera dużą ilość reszt Glu, stanowiących ~22% całości aminokwasu.
Przewidywanie struktury drugorzędowej i analizy hydrofobowości sugerują, że pierwotna sekwencja BSP ma otwartą, elastyczną strukturę z potencjałem do tworzenia regionów helisy α i niektórych arkuszy β . Jednak większość badań wykazała, że BSP nie ma struktury α-helikalnej ani β-arkusza na podstawie 1D NMR i dichroizmu kołowego. Analiza białka natywnego za pomocą mikroskopii elektronowej potwierdza, że białko ma rozciągniętą strukturę o długości około 40 nm. Ta elastyczna konformacja sugeruje, że białko ma niewiele domen strukturalnych, jednak sugerowano, że może istnieć kilka przestrzennie podzielonych domen funkcjonalnych, w tym hydrofobowa domena wiążąca kolagen ( reszty rattus norvegicus 36-57), region zarodkowy hydroksyapatytu przylegającej glutaminy reszty kwasowe ( reszty rattus norvegicus 78-85, 155-164) i klasyczny motyw wiążący integrynę (RGD) w pobliżu C-końca ( reszty rattus norvegicus 288-291).
Wykazano, że BSP jest w znacznym stopniu modyfikowane posttranslacyjnie, przy czym węglowodany i inne modyfikacje stanowią około 50% masy cząsteczkowej natywnego białka. Te modyfikacje, które obejmują N- i O- glikozylację , siarczanowanie tyrozyny oraz fosforylację seryny i treoniny , powodują, że białko jest wysoce heterogenne.
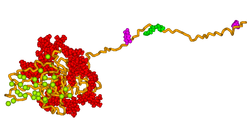
Model 3D sialoproteiny ludzkiej kości został opracowany przy użyciu technik modelowania molekularnego, jak pokazano na powyższym obrazku. Model sugeruje, że białko zapewnia elastyczną matrycę do szybkiego samoorganizacji jonów wapnia i fosforanów, zarodkując w ten sposób wzrost kryształów hydroksyapatytu.
Funkcjonować
Ilość BSP w kości i zębinie jest w przybliżeniu równa, jednak funkcja BSP w tych zmineralizowanych tkankach nie jest znana. Jedną z możliwości jest to, że BSP działa jako jądro do tworzenia pierwszych apatytu . Gdy apatyt tworzy się wzdłuż włókien kolagenowych w macierzy pozakomórkowej, BSP może następnie pomóc kierować, przekierowywać lub hamować wzrost kryształów.
Dodatkowe role BSP to angiogeneza i ochrona przed lizą komórek za pośrednictwem dopełniacza. Regulacja genu BSP jest ważna dla mineralizacji macierzy kostnej i wzrostu guza w kości.
Linki zewnętrzne
- Lokalizacja ludzkiego genomu IBSP i strona szczegółów genu IBSP w przeglądarce genomu UCSC .
Dalsza lektura
- Karadag A, Fisher LW (2006). „Sialoproteina kostna wzmaga migrację komórek zrębu szpiku kostnego przez matryce poprzez łączenie MMP-2 z alfa (v) beta3-integryną” . J. Bone Miner. Rez . 21 (10): 1627–36. doi : 10.1359/jbmr.060710 . PMID 16995818 . S2CID 84886034 .
- Barnes GL, Javed A, Waller SM i in. (2003). „Czynniki transkrypcyjne związane z osteoblastami Runx2 (Cbfa1 / AML3) i MSX2 pośredniczą w ekspresji sialoproteiny kostnej w ludzkich komórkach raka piersi z przerzutami”. Rak Res . 63 (10): 2631-7. PMID 12750290 .
- Carlinfante G, Vassiliou D, Svensson O i in. (2003). „Różnicowa ekspresja osteopontyny i sialoproteiny kostnej w przerzutach do kości raka piersi i prostaty”. Clin. Do potęgi. przerzuty . 20 (5): 437–44. doi : 10.1023/A:1025419708343 . PMID 14524533 . S2CID 341938 .
- Hwang Q, Cheifetz S, Ogólnie CM i in. (2009). „Sialoproteina kości nie oddziałuje z prożelatynazą A (MMP-2) ani nie pośredniczy w aktywacji MMP-2” . Rak BMC . 9 : 121. doi : 10.1186/1471-2407-9-121 . PMC 2679042 . PMID 19386107 .
- Styrkarsdottir U, Halldorsson BV, Gretarsdottir S, et al. (2009). „Nowe warianty sekwencji związane z gęstością mineralną kości”. Nat. Genet . 41 (1): 15–7. doi : 10.1038/ng.284 . PMID 19079262 . S2CID 9876454 .
- Zhang L, Hou X, Lu S i in. (2010). „Prognostyczne znaczenie sialoproteiny kostnej i osteopontyny dla przerzutów do kości u pacjentów z usuniętym chińskim niedrobnokomórkowym rakiem płuca: duże retrospektywne badanie kohortowe”. Rak płuc . 67 (1): 114-9. doi : 10.1016/j.lungcan.2009.03.017 . PMID 19376608 .
- Roca H, Phimphilai M, Gopalakrishnan R, et al. (2005). „Współdziałające interakcje między RUNX2 a miejscami wiązania białka homeodomeny mają kluczowe znaczenie dla specyficznej dla osteoblastów ekspresji genu sialoproteiny kości” . J. Biol. chemia . 280 (35): 30845–55. doi : 10.1074/jbc.M503942200 . PMID 16000302 .
- Lamour V, Detry C, Sanchez C i in. (2007). „Represja, w której pośredniczy Runx2 i deacetylaza histonowa 3, jest złagodzona w różnicowaniu ludzkich komórek osteoblastów, aby umożliwić wysoką ekspresję sialoproteiny kości” . J. Biol. chemia . 282 (50): 36240–9. doi : 10.1074/jbc.M705833200 . PMID 17956871 .
- Ogata Y (2008). „Sialoproteina kości i jej mechanizm regulacji transkrypcji”. Dziennik badań periodontologicznych . 43 (2): 127–35. doi : 10.1111/j.1600-0765.2007.01014.x . PMID 18302613 .
- Papotti M, Kalebic T, Volante M i in. (2006). „Sialoproteina kostna przewiduje przerzuty do kości w resekcyjnym niedrobnokomórkowym raku płuca: retrospektywne badanie kliniczno-kontrolne”. J. Clin. onkol . 24 (30): 4818–24. doi : 10.1200/JCO.2006.06.1952 . PMID 17050866 .
- Frank O, Heim M, Jakob M i in. (2002). „Analiza ilościowa RT-PCR w czasie rzeczywistym ludzkich komórek zrębowych szpiku kostnego podczas różnicowania osteogennego in vitro”. J. Komórka. Biochem . 85 (4): 737–46. doi : 10.1002/jcb.10174 . PMID 11968014 . S2CID 23595289 .
- Yerges LM, Klei L, Cauley JA i in. (2009). „Badanie asocjacyjne o dużej gęstości 383 genów kandydujących na wolumetryczne BMD w szyjce kości udowej i kręgosłupie lędźwiowym wśród starszych mężczyzn” . J. Bone Miner. Rez . 24 (12): 2039–49. doi : 10.1359/jbmr.090524 . PMC 2791518 . PMID 19453261 .
- Gordon JA, Sodek J, Hunter GK, Goldberg HA (2009). „Sialoproteina kości stymuluje ogniskowe szlaki sygnałowe związane z adhezją: rola w migracji i przeżyciu komórek raka piersi i prostaty”. J. Komórka. Biochem . 107 (6): 1118–28. doi : 10.1002/jcb.22211 . PMID 19492334 . S2CID 36937586 .
- Araki S, Mezawa M, Sasaki Y i in. (2009). „Regulacja parathormonu transkrypcji ludzkiego genu sialoproteiny kostnej odbywa się za pośrednictwem dwóch elementów odpowiedzi cAMP”. J. Komórka. Biochem . 106 (4): 618–25. doi : 10.1002/jcb.22039 . PMID 19127545 . S2CID 5586385 .
- Wuttke M, Müller S, Nitsche DP, Paulsson M, Hanisch FG, Maurer P (wrzesień 2001). „Charakterystyka strukturalna ludzkiej rekombinowanej i pochodzącej z kości sialoproteiny kostnej. Implikacje funkcjonalne dla przyczepiania się komórek i wiązania hydroksyapatytu” . J. Biol. chemia . 276 (39): 36839–48. doi : 10.1074/jbc.M105689200 . PMID 11459848 .
- Hilbig H, Wiener T, Armbruster FP i in. (2005). „Wpływ powierzchni implantów dentystycznych na ekspresję sialoprotein kostnych w komórkach pochodzących z ludzkiej kości żuchwy”. Med. nauka monit . 11 (4): BR111–5. PMID 15795688 .
- Koller DL, Ichikawa S, Lai D i in. (2010). „Badanie asocjacyjne całego genomu dotyczące gęstości mineralnej kości u Europejek-Amerykanek przed menopauzą i replikacji u kobiet afroamerykańskich” . J. Clin. Endokrynol. Metab . 95 (4): 1802–9. doi : 10.1210/jc.2009-1903 . PMC 2853986 . Identyfikator PMID 20164292 .
- Strausberg RL, Feingold EA, Grouse LH i in. (2002). „Generowanie i wstępna analiza ponad 15 000 pełnej długości sekwencji cDNA człowieka i myszy” . proc. Natl. Acad. nauka USA . 99 (26): 16899–903. Bibcode : 2002PNAS...9916899M . doi : 10.1073/pnas.242603899 . PMC 139241 . PMID 12477932 .
- Fujisawa R (2002). „[Ostatnie postępy w badaniach nad białkami macierzy kostnej]”. Nippon Rinsho . 60 Suppl 3: 72–8. PMID 11979972 .
- Loibl S, Königs A, Kaufmann M, Costa SD, Bischoff J (grudzień 2006). „[PTHrP i sialoproteina kostna jako markery prognostyczne rozwoju przerzutów do kości u pacjentów z rakiem piersi]”. Zentralbl Gynakol (w języku niemieckim). 128 (6): 330–5. doi : 10.1055/s-2006-942314 . PMID 17213971 .
- Uccello M, Malaguarnera G, Vacante M i in. (2011). „Poziomy sialoprotein w kościach w surowicy i przerzuty do kości” . J. Cancer Res. tam . 7 (2): 115–9. doi : 10.4103/0973-1482.82912 . PMID 21768695 .



