Synteza piperydonu Petrenko-Kritschenko
| Synteza piperydonu Petrenko-Kritschenko | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwany po | Paweł Petrenko-Kritschenko | ||||||||||||||
| Typ reakcji | wieloskładnikowa kondensacja pierścieniowa | ||||||||||||||
| Reakcja | |||||||||||||||
|
|||||||||||||||
| Warunki | |||||||||||||||
| Typowe rozpuszczalniki | zazwyczaj woda lub alkohole w temperaturze pokojowej | ||||||||||||||
Reakcja Petrenko-Kritschenko jest klasyczną reakcją wieloskładnikową, która jest blisko spokrewniona z syntezą tropinonu Robinsona-Schöpfa , ale została opublikowana 12 lat wcześniej.
Klasyczna reakcja
W oryginalnej publikacji dietylo-α-ketogluran, pochodna kwasu acetonodikarboksylowego , jest stosowana w połączeniu z amoniakiem i benzaldehydem. Względna stereochemia nie została wyjaśniona w oryginalnej publikacji, analiza strukturalna za pomocą promieni rentgenowskich lub NMR nie była wówczas dostępna. W przypadku braku amoniaku lub soli amonowych powstaje 4-oksotetrahydropiran.
W przeciwieństwie do syntezy Robinsona, nie wykorzystuje dialdehydów, takich jak aldehyd bursztynowy czy aldehyd glutarowy , ale prostsze aldehydy, takie jak benzaldehyd . Dlatego produktem reakcji nie jest struktura bicykliczna (patrz tropinon i pseudopelletieryna ), ale 4-piperydon. Syntezę tropinonu można postrzegać jako odmianę reakcji Petrenko-Kritschenko, w której dwie funkcje aldehydowe są kowalencyjnie połączone w jednej cząsteczce. Oprócz syntezy Hantzscha reakcja Petrenko-Kritschenko jest jednym z nielicznych przykładów, w których symetryczny prekursor pirydyny można otrzymać w wieloskładnikowej reakcji kondensacji pierścienia, po której następuje utlenianie. Utlenianie tritlenkiem chromu w kwasie octowym prowadzi do symetrycznie podstawionego 4-pirydonu, dekarboksylacja daje 3,5-niepodstawioną pochodną.
Nowoczesne warianty
Acetooctan można stosować zamiast α-ketogluranu dietylu w obecności soli indu . Użycie aniliny zostało również opisane w oryginalnej publikacji. Produkt tej reakcji wykazuje transoidową konfigurację grup fenylowych przy C-2 i C-6.
Synteza produktów naturalnych
Reakcja została wykorzystana do przygotowania prekokcyneliny, alkaloidu występującego w niektórych biedronkach .
Zastosowania w chemii koordynacyjnej
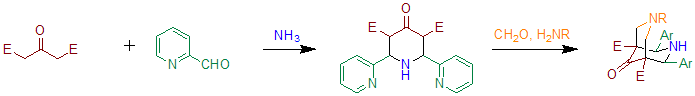
Gdy benzaldehyd jest podstawiony 2-pirydynokarboksyaldehydem, reakcję można wykorzystać do przygotowania prekursorów bispidonu-ligandów. Zasadniczo ta metoda opiera się na dwóch kolejnych reakcjach Petrenko-Kritschenko. Ligandy te można stosować do wytwarzania związków zawierających wysokowartościowe żelazo , które są zdolne do utleniania cykloheksanu w obecności nadtlenku wodoru .
- ^ a b Jie-Jack Li; „Nazwa reakcji w chemii heterocyklicznej”; 2005 John Wiley & Synowie; ISBN 0-471-30215-5 ; str. 313
- ^ a b c P. Petrenko-Kritschenko „Über die Kondensation des Acetondicarbonsäureesters mit Aldehyden, Ammoniak und Aminen” Journal für Praktische Chemie tom 85, wydanie 1, strony 1–37, 20 maja 1912; doi : 10.1002/prac.19110850101
- ^ P. Petrenko-Kritschenko „Über Tetrahydropyronverbindungen” Journal für Praktische Chemie; Tom 60, wydanie 1, strony 140–158, 27 grudnia 1899; doi : 10.1002/prac.18990600114
- ^ Clarke, Paweł A.; Zajcew, Andriej W.; Whitwood, Adrian C. „Ekonomiczna synteza garnkowa, atomowa i krokowa (PASE) wysoce sfunkcjonalizowanych piperydyn: pięcioskładnikowa kondensacja” Tetrahedron Letters, tom 48, wydanie 30, 23 lipca 2007, strony 5209–5212; doi : 10.1016/j.tetlet.2007.05.141
- ^ Comba, Piotr; Kerscher, Marion; Merz, Michael; Müller, Vera; Pritzkow, Hans; Remenyi, Rainer; Schiek, Wolfgang; Xiong, Yun „Structural Variation in Transition-Metal Bispidine Compounds” Chemistry - A European Journal, tom 8, wydanie 24, strony 5750–5760, 16 grudnia 2002 r .; doi : 10.1002/1521-3765(20021216)8:24<5750::AID-CHEM5750>3.0.CO;2-P
Linki zewnętrzne
- Zdjęcie Paula Petrenko-Kritschenko zrobione w Kazańskiej Szkole Chemii w 1928 roku (pierwszy rząd, pierwszy od lewej): http://www.ksu.ru/chmku/images/30b.jpg