streptogramina B
Streptogramina B jest podgrupą rodziny antybiotyków streptograminowych . Te naturalne produkty to cykliczne heksa- lub hepta- depsipeptydy wytwarzane przez różnych członków rodzaju bakterii Streptomyces . Wiele członków streptogramin opisanych w literaturze ma tę samą strukturę i różne nazwy; na przykład pristinamycyna IA = wernamycyna Bα = mikamycyna B = osteogrycyna B.
Biosynteza
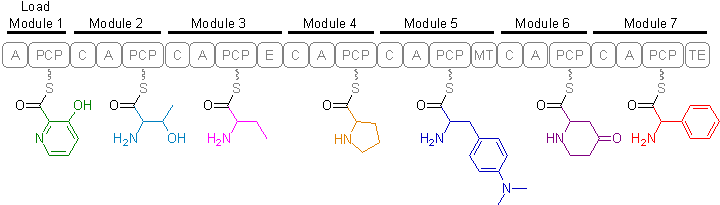
Biosynteza streptograminy B jest przeprowadzana przez duże wielofunkcyjne enzymy zwane nierybosomalnymi syntetazami peptydowymi (NRPS). W systemie NRPS każdy aminokwas jest aktywowany jako aminoacyladenylan i jest połączony z enzymem jako tioester z grupą fosfopanteteinylową. Następnie zachodzi reakcja wydłużania poprzez przeniesienie aktywowanego karboksylu do grupy aminowej w następnym aminokwasie, przeprowadzając w ten sposób stopniową kondensację N-do-C.
NRPS zawierają kilka modułów na jednym polipeptydzie. Każdy z tych modułów może katalizować reakcję aktywacji, kondensacji i modyfikacji specyficzną dla jednego rodzaju aminokwasu. Typowy moduł elongacyjny składa się z domeny adenylacji (A), domeny białka nośnikowego peptydylu (PCP) i domeny kondensacji (C). Mogą być obecne inne domeny odpowiedzialne za modyfikacje reszt, takie jak domena epimeryzacji (E) i domena N-metylotransferazy (MT). Domeną odpowiedzialną za terminację jest domena tioesterazy (TE) zlokalizowana w ostatnim module.
Skład aminokwasowy
Ogólny skład aminokwasowy streptograminy B obejmuje: Kwas 3-hydroksypikolinowy, L-treonina, Kwas D-aminomasłowy, L-prolina, 4-N,N-(dimetyloamino)-L-fenyloalanina, 4-okso-L-pipekolowy kwas i fenyloglicyna .
Układ modułowy
Mechanizm akcji
Streptograminy A i B synergistycznie hamują wzrost komórek bakterii Gram-dodatnich , w mniejszym stopniu Gram-ujemnych poprzez hamowanie syntezy białek, ale oddzielnie działają bakteriostatycznie. Molekularnym celem streptogramin jest 23S rRNA. Zarówno streptogramina A, jak i B wiążą się z miejscem wiązania P podjednostki 50S rybosomu. Wiązanie streptograminy typu A powoduje zmianę konformacyjną podjednostki 50S, co zwiększa aktywność streptograminy typu B 100-krotnie. Streptogramina B zapobiega wydłużaniu łańcuchów białkowych i powoduje uwalnianie niekompletnych peptydów.
Zastosowanie kliniczne
Antybiotyki streptograminowe zostały zidentyfikowane prawie 50 lat temu, ale dopiero niedawno znalazły zastosowanie kliniczne w wyniku wzrostu liczby bakterii opornych na wiele leków . Wykazują słabą rozpuszczalność w roztworze wodnym, co ogranicza ich zastosowanie kliniczne; jednak produkty naturalne nadal znajdują zastosowanie jako dodatki paszowe w rolnictwie.
Chemicy medyczni z Rhône-Poulenc pracowali nad przygotowaniem półsyntetycznych, rozpuszczalnych w wodzie pochodnych pristinamycyny IA (streptogramina typu B) i prystynamycyny IIA (streptogramina typu A), dających odpowiednio chinuprystynę i dalfoprystynę , które po podaniu w stosunek 3:7 obejmuje zatwierdzony przez FDA w 1999 r. lek Synercid .