Pęcherzyk gazowy
Pęcherzyki gazowe , znane również jako wakuole gazowe , to nanokompartmenty w niektórych organizmach prokariotycznych , które pomagają w wyporności. Pęcherzyki gazowe składają się wyłącznie z białka ; nie wykryto lipidów ani węglowodanów.
Funkcjonować
wyporu komórki i modyfikowania pozycji komórki w słupie wody, aby mogła być optymalnie zlokalizowana do fotosyntezy lub przemieszczać się do miejsc z większą lub mniejszą ilością tlenu. Organizmy, które mogą unosić się na granicy faz powietrze-ciecz, konkurują z innymi tlenowcami, które nie mogą unosić się w słupie wody, zużywając tlen w górnej warstwie.
Ponadto pęcherzyki gazu można wykorzystać do utrzymania optymalnego zasolenia poprzez umieszczenie organizmu w określonych miejscach w uwarstwionym zbiorniku wodnym, aby zapobiec szokowi osmotycznemu . Wysokie stężenie substancji rozpuszczonej spowoduje wysysanie wody z komórki przez osmozę , powodując lizę komórki. Zdolność do syntezy pęcherzyków gazowych jest jedną z wielu strategii, które pozwalają organizmom halofilnym tolerować środowiska o wysokiej zawartości soli.
Ewolucja
Pęcherzyki gazowe są prawdopodobnie jednym z najwcześniejszych mechanizmów ruchliwości wśród mikroskopijnych organizmów ze względu na fakt, że jest to najbardziej rozpowszechniona forma ruchliwości zachowana w genomie prokariotów, z których część wyewoluowała około 3 miliardów lat temu. Tryby aktywnej ruchliwości, takie jak ruch wici, wymagają mechanizmu, który mógłby przekształcić energię chemiczną w energię mechaniczną, a zatem jest znacznie bardziej złożony i wyewoluowałby później. Funkcje pęcherzyków gazowych są również w dużej mierze zachowane wśród gatunków, chociaż tryb regulacji może się różnić, co sugeruje znaczenie pęcherzyków gazowych jako formy ruchliwości. W niektórych organizmach, takich jak Enterobacterium Serratia sp. Ruchliwość oparta na wici i wytwarzanie pęcherzyków gazowych są regulowane przeciwnie przez pojedyncze białko wiążące RNA, RsmA, co sugeruje alternatywne tryby adaptacji środowiskowej, które rozwinęłyby się w różne taksony poprzez regulację rozwoju między ruchliwością a flotacją.
Chociaż istnieją dowody sugerujące wczesną ewolucję pęcherzyków gazowych, transfer plazmidu służy jako alternatywne wyjaśnienie powszechnego i konserwatywnego charakteru organelli. Rozszczepienie plazmidu w Halobacterium halobium spowodowało utratę zdolności do biosyntezy pęcherzyków gazowych, co wskazuje na możliwość horyzontalnego transferu genów , co może skutkować przeniesieniem zdolności do wytwarzania pęcherzyków gazowych pomiędzy różnymi szczepami bakterii.
Struktura

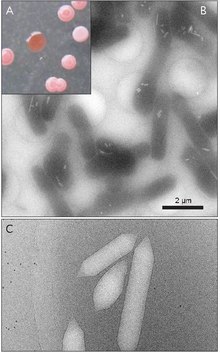
Pęcherzyki gazowe są zazwyczaj w kształcie cytryny lub cylindryczne, wydrążone rurki białka ze stożkowymi nasadkami na obu końcach. Pęcherzyki najbardziej różnią się średnicą. Większe pęcherzyki mogą pomieścić więcej powietrza i zużywają mniej białka, co czyni je najbardziej ekonomicznymi pod względem wykorzystania zasobów, jednak im większy pęcherzyk, tym strukturalnie słabszy jest pod ciśnieniem i tym mniejsze ciśnienie jest wymagane, zanim pęcherzyk się zapadnie. Organizmy ewoluowały, aby być najbardziej wydajnymi w wykorzystywaniu białka i wykorzystywać największą maksymalną średnicę pęcherzyków, która wytrzyma ciśnienie, na które organizm może być narażony. Aby dobór naturalny wpłynął na pęcherzyki gazu, średnica pęcherzyków musi być kontrolowana przez genetykę. Chociaż geny kodujące pęcherzyki gazowe występują u wielu gatunków haloarchea , tylko kilka gatunków je wytwarza. Pierwszy gen pęcherzyka gazu Haloarchaeal, GvpA, sklonowano z Halobacterium sp. NRC-1. 14 genów bierze udział w tworzeniu pęcherzyków gazowych w haloarchaea.
Pierwszy gen pęcherzyków gazowych, GvpA, został zidentyfikowany w Calothrix. Istnieją co najmniej dwa białka, które tworzą pęcherzyk gazowy cyjanobakterii: GvpA i GvpC. GvpA tworzy żebra i znaczną część masy (do 90%) głównej konstrukcji. GvpA jest silnie hydrofobowy i może być jednym z najbardziej hydrofobowych znanych białek. GvpC jest hydrofilowy i pomaga stabilizować strukturę poprzez okresowe inkluzje w żebrach GvpA. GvpC może zostać wypłukany z pęcherzyka, co w konsekwencji powoduje spadek wytrzymałości pęcherzyka. Grubość ściany pęcherzyka może wynosić od 1,8 do 2,8 nm. Żebrowana struktura pęcherzyka jest widoczna zarówno na wewnętrznej, jak i zewnętrznej powierzchni, z odstępami między żebrami 4–5 nm. Pęcherzyki mogą mieć długość 100–1400 nm i średnicę 45–120 nm.
W obrębie gatunku rozmiary pęcherzyków gazowych są stosunkowo jednolite, z odchyleniem standardowym ± 4%.
Wzrost
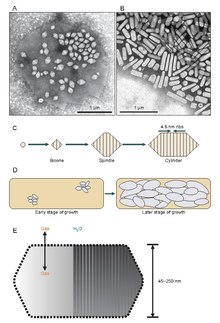
Wydaje się, że pęcherzyki gazu zaczynają swoje istnienie jako małe struktury dwustożkowe (dwa stożki o połączonych ze sobą płaskich podstawach), które powiększają się do określonej średnicy, a następnie rosną i zwiększają swoją długość. Nie wiadomo dokładnie, co kontroluje średnicę, ale może to być cząsteczka, która zakłóca GvpA lub kształt GvpA może się zmienić.
Rozporządzenie
Tworzenie pęcherzyków gazowych jest regulowane przez dwa białka Gvp: GvpD, które hamuje ekspresję białek GvpA i GvpC oraz GvpE, które indukuje ekspresję. Zewnątrzkomórkowe czynniki środowiskowe również wpływają na tworzenie się pęcherzyków, regulując produkcję białka Gvp lub bezpośrednio zaburzając strukturę pęcherzyków.
Natężenie światła
Stwierdzono, że intensywność światła wpływa na produkcję i utrzymanie pęcherzyków gazowych w różny sposób w zależności od różnych bakterii i archeonów. W przypadku Anabaena flos-aquae wyższe natężenie światła prowadzi do zapadania się pęcherzyków w wyniku wzrostu ciśnienia turgoru i większej akumulacji produktów fotosyntezy. W sinicach wytwarzanie pęcherzyków zmniejsza się przy dużym natężeniu światła z powodu ekspozycji powierzchni bakterii na promieniowanie UV, które może uszkodzić genom bakterii.
Węglowodany
Stwierdzono, że nagromadzenie glukozy, maltozy lub sacharozy w Haloferax mediterranei i Haloferax volcanii hamuje ekspresję białek GvpA, a tym samym zmniejsza wytwarzanie pęcherzyków gazowych. Jednak miało to miejsce tylko we wczesnej wykładniczej fazie wzrostu komórki. Tworzenie się pęcherzyków można również indukować zmniejszając zewnątrzkomórkowe stężenia glukozy.
Tlen
Stwierdzono, że brak tlenu negatywnie wpływa na tworzenie się pęcherzyków gazu u halofilnych archeonów. Halobacterium salinarum wytwarzają niewiele pęcherzyków lub nie wytwarzają ich wcale w warunkach beztlenowych z powodu zmniejszonej syntezy transkryptów mRNA kodujących białka Gvp. H. mediterranei i H. volcanii nie wytwarzają żadnych pęcherzyków w warunkach beztlenowych z powodu zmniejszenia syntetyzowanych transkryptów kodujących GvpA i skróconych transkryptów wyrażających GvpD.
pH
Stwierdzono, że zwiększone zewnątrzkomórkowe poziomy pH zwiększają tworzenie się pęcherzyków u gatunków Microcytis. Przy podwyższonym pH poziom gvpA i gvpC wzrasta, umożliwiając większą ekspozycję na rybosomy w celu ekspresji i prowadząc do regulacji w górę białek Gvp. Można to przypisać większej transkrypcji tych genów, zmniejszonemu rozkładowi zsyntetyzowanych transkryptów lub większej stabilności mRNA.
Promieniowanie ultradźwiękowe
Stwierdzono, że promieniowanie ultradźwiękowe o określonych częstotliwościach zapada pęcherzyki gazu w sinicach Spirulina platensis , zapobiegając ich kwitnieniu.
Quorum sensing
W enterobakteriach; Serratia sp. szczepu ATCC39006 pęcherzyki gazowe są wytwarzane tylko wtedy, gdy występuje wystarczające stężenie cząsteczki sygnałowej, laktonu N-acylo-homoseryny. W tym przypadku wykrywająca kworum , lakton N-acylo-homoseryny, działa jako morfogen inicjujący rozwój organelli. Jest to korzystne dla organizmu, ponieważ zasoby do produkcji pęcherzyków gazowych są wykorzystywane tylko wtedy, gdy występuje ograniczenie tlenu spowodowane wzrostem populacji bakterii.
Rola w rozwoju szczepionek
Gen pęcherzyków gazowych gvp C z Halobacterium sp. jest używany jako system dostarczania do badań szczepionek.
Kilka cech białka kodowanego przez gen pęcherzyka gazowego gvp C pozwala na stosowanie go jako nośnika i adiuwanta dla antygenów: jest stabilne, odporne na degradację biologiczną, toleruje stosunkowo wysokie temperatury (do 50°C) i niepatogenne do ludzi. Kilka antygenów z różnych ludzkich patogenów zostało zrekombinowanych z gvp C w celu stworzenia szczepionek podjednostkowych o długotrwałych odpowiedziach immunologicznych.
Różne segmenty genomowe kodujące kilka białek patogenu Chlamydia trachomatis , w tym MOMP, OmcB i PompD, są połączone z genem gvp C Halobacteria . Oceny komórek in vitro pokazują ekspresję genów Chlamydia na powierzchni komórek za pomocą technik obrazowania i wykazują charakterystyczne odpowiedzi immunologiczne, takie jak aktywność TLR i wytwarzanie cytokin prozapalnych. Gen pęcherzyków gazowych można wykorzystać jako nośnik dostarczający do wytworzenia potencjalnej szczepionki przeciwko chlamydii. Ograniczenia tej metody obejmują konieczność zminimalizowania uszkodzenia samego białka GvpC przy jednoczesnym włączeniu jak największej części docelowego genu szczepionki do segmentu gvp C.
W podobnym eksperymencie wykorzystano ten sam gen pęcherzyków gazowych i wydzielane przez patogen Salmonella enterica efektorowe białko efektorowe fosforanu inozyny SopB4 i SopB5 do wygenerowania potencjalnego wektora szczepionki. Immunizowane myszy wydzielają prozapalne cytokiny IFN-γ, IL-2 i IL-9. Wykrywa się również przeciwciało IgG. Po prowokacji infekcją w pobranych narządach, takich jak śledziona i wątroba, nie znaleziono żadnych bakterii lub znacznie mniej. Potencjalne szczepionki wykorzystujące pęcherzyki gazowe jako ekspozycję antygenową można podawać drogą śluzówkową jako alternatywną drogę podawania, zwiększając ich dostępność dla większej liczby osób i wywołując szerszy zakres odpowiedzi immunologicznych w organizmie.
Rola jako środków kontrastowych i genów reporterowych
Pęcherzyki gazu mają kilka właściwości fizycznych, które czynią je widocznymi w różnych metodach obrazowania medycznego . Zdolność pęcherzyków gazu do rozpraszania światła była wykorzystywana od dziesięcioleci do szacowania ich stężenia i mierzenia ciśnienia zapadania się. Kontrast optyczny pęcherzyków gazowych sprawia, że mogą one również służyć jako środki kontrastowe w optycznej tomografii koherencyjnej , z zastosowaniami w okulistyce . Różnica w impedancji akustycznej między gazem w ich rdzeniach a otaczającym płynem daje pęcherzykom gazowym silny kontrast akustyczny. Co więcej, zdolność niektórych powłok pęcherzyków gazowych do wyginania się generuje harmoniczne echa ultradźwiękowe, które poprawiają stosunek kontrastu do tkanki. Wreszcie, pęcherzyki gazu mogą być stosowane jako środki kontrastowe do obrazowania metodą rezonansu magnetycznego (MRI), opierając się na różnicy między podatnością magnetyczną powietrza i wody. Zdolność do nieinwazyjnego zapadania się pęcherzyków gazu za pomocą fal ciśnienia zapewnia mechanizm usuwania ich sygnału i poprawy ich kontrastu. Odejmowanie obrazów przed i po zapaści akustycznej może wyeliminować sygnały tła, poprawiając wykrywanie pęcherzyków gazu.
Heterologiczna ekspresja pęcherzyków gazu w komórkach bakteryjnych i ssaczych umożliwiła ich wykorzystanie jako pierwszej rodziny akustycznych genów reporterowych . Podczas gdy fluorescencyjne geny reporterowe, takie jak zielone białko fluorescencyjne (GFP), były szeroko stosowane w biologii, ich zastosowania in vivo są ograniczone przez głębokość penetracji światła w tkance, zwykle kilka mm. Luminescencję można wykryć głębiej w tkance, ale mają one niską rozdzielczość przestrzenną. Akustyczne geny reporterowe zapewniają submilimetrową rozdzielczość przestrzenną i kilkucentymetrową głębokość penetracji, umożliwiając badanie in vivo procesów biologicznych głęboko w tkance.
