Bakteryjny transporter leucyny
| Bakteryjny transporter leucyny | |||||||
|---|---|---|---|---|---|---|---|
|
Symulacja dynamiki molekularnej LeuT wygenerowana przy użyciu
| |||||||
| identyfikatorów GROMACS | |||||||
| Symbol | LeuT | ||||||
| WPB | 3F3E | ||||||
| RefSeq | NC_000918.1. NP_214423.1. NC_000918.1. | ||||||
| UniProt | O67854 | ||||||
| |||||||
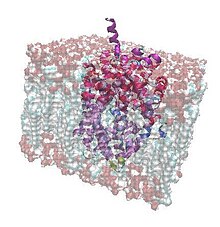
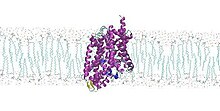
Bakteryjny transporter leucyny ( LeuT ) jest białkiem złożonym z dwunastu helis alfa , które należy do rodziny transporterów, które przenoszą aminokwasy do iz komórek bakteryjnych . Specjalizujący się w małych hydrofobowych aminokwasach, takich jak leucyna i alanina , ten transporter jest zasilany gradientem jonów sodu , który normalnie jest utrzymywany przez zdrowe komórki przez ich błony. LeuT działa jak symporter , co oznacza, że łączy przejście jonu sodu przez błonę komórkową z transportem aminokwasu w tym samym kierunku. Po raz pierwszy został skrystalizowany, aby zrozumieć wewnętrzne mechanizmy molekularne przeciwdepresyjnych , ponieważ jest bardzo podobny do ludzkich transporterów neuroprzekaźników (trudniejszych do krystalizacji), które te leki blokują, hamując w ten sposób wychwyt przekaźników chemicznych przez błonę komórkową nerwu aksony i komórki glejowe .
Struktura
LeuT jest homodimerem złożonym z dwóch identycznych podjednostek , które stykają się w dwóch punktach. Każdy z tych łańcuchów polipeptydowych ma wysokość około 70 urn i średnicę 48 urn. Jego masa formuły wynosi 58078,2 Da.
Składa się głównie z pozostałości hydrofobowych. Są one w kontakcie z wnętrzem dwuwarstwy , podczas gdy reszty hydrofilowe są w kontakcie z przestrzenią zewnątrzkomórkową i wewnątrzkomórkową. Biorąc pod uwagę, że jest to białko transbłonowe , jest to istotna cecha, ponieważ może wchodzić w interakcje zarówno z wodą, jak i fosfolipidami.
Struktura drugorzędowa tego transportera składa się z dwunastu helis alfa i dwóch krótkich nici beta . Można również znaleźć pętle łączące je .
Ponieważ LeuT jest symporterem i wykorzystuje potencjał elektrochemiczny jonów sodu do ułatwienia transportu leucyny, zarówno jony sodu, jak i aminokwas hydrofobowy, leucyna (Leu), wiążą się z centrum tego białka. Reszty zaangażowane w to wiązanie znajdują się na transbłonowych segmentach helisy alfa 1, 3, 6 i 8.
Funkcjonować
Bacterial Leucine Transporter importuje leucynę z zewnątrz komórki do wnętrza za pomocą dwóch jonów sodu. Jest homologiem białek, które usuwają przekaźniki chemiczne z synaps i wspomagają neuroprzekaźnictwo, takie jak transportery serotoniny , dopaminy , noradrenaliny , glicyny czy GABA (kwasu -aminomasłowego) w neuronach. Te specyficzne białka transportowe oczyszczają synapsę po sygnale nerwowym, transportując neuroprzekaźniki z powrotem do aksonu i przygotowując go na kolejny sygnał.
LeuT jest jednym z dziesiątek transporterów, które przenoszą aminokwasy do iz komórek bakteryjnych. Leucyna i alanina to główne aminokwasy, które to białko przenosi przez błonę, ponieważ ma wysokie powinowactwo do tych małych cząsteczek hydrofobowych. Ponadto hydrofobowy charakter powierzchni białka dobrze uzupełnia hydrofobowy charakter błony komórkowej. Transport jest napędzany gradientem jonów sodu, który generuje różnicę potencjałów elektrycznych między przestrzenią wewnętrzną i zewnątrzkomórkową. LeuT działa jako symporter , integralne białko błonowe, które działa jako kotransporter , łącząc przejście dwóch jonów sodu przez błonę z transportem aminokwasu w tym samym kierunku, czyniąc proces korzystnym energetycznie. Różnica stężeń tworzy gradient potencjału elektrochemicznego, który jest używany do katalizowania wychwytu substratów organicznych (w tym przypadku leucyny). Transport nie jest zależny od żadnego innego źródła energii (na przykład ATP).
Transporter leucyny, podobnie jak transportery neuroprzekaźników w komórkach nerwowych, ma wiązkę dwunastu helis alfa, które tworzą kanał transportowy przez błonę. W tym celu to białko bakteryjne zapewnia potężny model do badania szczegółów atomowych tych białek nerwowych. Ludzkie homologi LeuT są zależne od jonów chloru, jak również od stężenia jonów sodu: wszystkie należą do klasy transporterów zależnych od Na+/Cl-.
Zmiana konformacyjna
Uważa się, że białko działa jak przełącznik kołyskowy. Otwiera się w kierunku przestrzeni zewnątrzkomórkowej, dzięki czemu jony leucyny i sodu mogą się do niej dostać i związać. Następnie LeuT przechodzi zmianę konformacyjną , która uwalnia obie cząsteczki do wnętrza komórki. Uważa się, że dwa zestawy helis alfa wykonują działanie kołyszące, bezpośrednio zmieniając swój kształt po związaniu aminokwasu ze strukturą. Ta zmiana jest konieczna, aby białko mogło funkcjonować. Jeśli wiąże się z nim lek, taki jak antydepresant, aktywność transportowa jest dramatycznie zmniejszona.
Wiązanie z lekami przeciwdepresyjnymi
LeuT został po raz pierwszy skrystalizowany przez New York Consortium on Membrane Protein Structure (NYCOMPS) i innych badaczy z gatunku bakterii Aquifex aeolicus w celu zrozumienia leżących u podstaw mechanizmów molekularnych wiązania leków przeciwdepresyjnych z białkami docelowymi, transporterami neuroprzekaźników . Ponieważ białka te okazały się trudne do krystalizacji, LeuT okazał się obiecującym homologiem do dokowania tych leków.
Leki przeciwdepresyjne, takie jak selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI), wiążą się w dużej jamie przy zewnętrznym wejściu białka, nie bezpośrednio poprzez konkurencyjne hamowanie miejsca wiązania leucyny, ale przypuszczalnie blokując ruch białka, który jest niezbędny do przejścia zmiany konformacyjnej co prowadzi do uwolnienia leucyny. Są one utrzymywane przez pętlę spinki do włosów i mostek solny otoczony przez leucynę (Leu25/Leu29), glicynę (Gly26), argininę (Arg30), tyrozynę (Tyr108), izoleucynę (Ile111) i fenyloalaninę (Phe253).
Istnieją jednak dowody na to, że leki przeciwdepresyjne mogą wiązać się nieco głębiej w otwarciu ludzkich transporterów neuroprzekaźników, ze względu na ich różnice w stosunku do LeuT; są to bardziej upakowane struktury i przedłużenia na końcach łańcucha, które umożliwiają im interakcję z innymi białkami w komórce nerwowej. Zgodnie z tym, jak widać na poniższym obrazku, homologia sekwencji między ludzkim transporterem serotoniny zależnym od sodu (celem SSRI) a LeuT wynosi tylko 21,5%, chociaż trójwymiarowa struktura obu białek ma bliskie podobieństwo.
LeuT to tylko pierwszy krok w tej fascynującej historii. W 2013 roku struktura transportera dopaminy została skrystalizowana promieniami X ; taki sukces utorował drogę do lepszego zrozumienia tego procesu.
Dopasowanie sekwencji między ludzkim transporterem serotoniny a LeuT, wygenerowane przy użyciu Clustal Omega:
„*” dotyczy tego samego aminokwasu // „:” odpowiada podstawieniu konserwowanemu (takie same właściwości chemiczne) // „.” odpowiada za podstawienie półkonserwatywne (podobna struktura)
Zobacz też
- Transport aktywny
- Białko transportujące błonę
- Transporter neuroprzekaźników
- Farmakologia leków przeciwdepresyjnych