CSNK1D
| CSNK1D | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , ASPS, CKIdelta, FASPS2, HCKID, kinaza kazeinowa 1 delta, CKId, CKI-delta | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer WE | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Izoforma kinazy kazeinowej I, znana również jako CKI-delta lub CK1δ , jest enzymem kodowanym u ludzi przez gen CSNK1D , który znajduje się na chromosomie 17 (17q25.3). Jest członkiem rodziny CK1 (dawniej nazywanej kinazą kazeinową 1) eukariotycznych kinaz serynowo-treoninowych , obejmujących siedem różnych izoform (CK1α, γ1-3, δ, ε), jak również różne warianty splicingowe poddane obróbce potranskrypcyjnej (transkrypcja warianty, telewizory) u ssaków . Tymczasem białka homologiczne do CK1δ zostały wyizolowane z organizmów takich jak drożdże , podstawczaki , rośliny , algi i pierwotniaki .
Kodowanie genetyczne
W 1993 roku sekwencja genu CK1δ została po raz pierwszy opisana przez Gravesa i in. który wyizolował cDNA z jąder szczurów. Po zsekwencjonowaniu i scharakteryzowaniu genu, konstrukt opisano jako sekwencję 1284 nukleotydów, w wyniku której po transkrypcji otrzymano białko składające się z 428 aminokwasów. Masa cząsteczkowa odpowiedniego białka została opublikowana jako 49 kDa. Trzy lata później ten sam gen został zidentyfikowany u ludzi. Ludzki CSNK1D zawiera 1245 nukleotydów i jest transkrybowany do białka składającego się z 415 aminokwasów.
Od tego czasu CK1δ badano i opisywano u różnych zwierząt, roślin, a także pasożytów ( Caenorhabditis elegans , 1998; Drosophila melanogaster , 1998; Mus musculus , 2002; Xenopus laevis , 2002).
Warianty transkrypcyjne
Jak dotąd opisano trzy różne warianty transkrypcji (TV) dla CK1δ u ludzi ( Homo sapiens ), myszy ( Mus musculus ) i szczurów ( Rattus norvegicus ), które są wysoce homologiczne. Dopasowanie wszystkich sekwencji CK1δ wszystkich organizmów wykazuje wysoką homologię w pierwszych 399 aminokwasach, z wyjątkiem pozycji 381. Podczas gdy ludzkie warianty transkrypcji wykorzystują izoleucynę, mysie i szczurze sekwencje zamiast tego zawierają walinę. Jedynym wyjątkiem jest szczurzy TV3, który również dokonuje transkrypcji swojej sekwencji nukleotydowej na izoleucynę.
Po pozycji 399 można zaobserwować trzy różne struktury ogólne. Pierwszy wariant składa się z 415 aminokwasów we wszystkich trzech organizmach i nosi nazwę TV1 u ludzi i szczurów, podczas gdy mysi odpowiednik nosi nazwę CRAa. Najkrótsza grupa sekwencji składa się z 409 aminokwasów: TV2 u ludzi i szczurów, CRAc u myszy. Najdłuższy wariant składa się z 428 aminokwasów u szczura (TV3) i myszy (CRAb), podczas gdy w wariancie ludzkim (TV3) brakuje przedostatniego aminokwasu (treoniny), co daje białko o długości 427 aminokwasów.
Różne warianty transkrypcji opierają się na różnym zastosowaniu egzonów kodujących CSNK1D . Cały gen składa się z jedenastu różnych egzonów i znajduje się u ludzi na chromosomie 17 w pozycji 17q25.3. CSNK1D ma długość 35 kb i zachodzi na gen Slc16a3 . Częścią przecinającą jest ekson 11, który znajduje się poniżej eksonu 10. Jednak nie koliduje z Slc16a3 , ponieważ znajduje się w obszarze niekodującym.
TV1 i TV2 postulowano podczas wczesnej analizy genów ludzkich i mysich w 2002 r. Oba warianty transkrypcji mają wspólne pierwsze 399 aminokwasów, ale różnią się odpowiednio kolejnymi 16 aminokwasami dla TV1 i dziesięcioma aminokwasami dla TV2. Jest to związane z wykorzystaniem egzonu. Podczas gdy dzielą pierwsze osiem egzonów, TV1 używa eksonu 10 i eksonu TV2 9, aby zakończyć ich odpowiednią sekwencję. Trzeci wariant transkrypcji został postulowany po analizie banku danych w roku 2014. Proponowana sekwencja dzieli pierwsze 399 aminokwasów z TV1 i TV2, ale różni się w kolejnych 28 aminokwasach. Wykorzystanie egzonu TV3 składa się z eksonu od 1 do 8, po którym następuje egzon 11, aby zakończyć sekwencję.
Oprócz różnych sekwencji trzech różnych wariantów transkrypcji, warianty wykazują również różnice w parametrach kinetycznych Michaelisa-Mentena (Km i Vmax ) w odniesieniu do ich potencjału do fosforylacji kanonicznej (α-kazeiny), jak również niekanonicznej (GST- substraty β-kateniny 1-181 ) (Xu i in., 2019). TV3 wykazuje wzrost fosforylacji obu substratów w porównaniu z TV1 i TV2, co jest statystycznie istotne. Różnice te można wytłumaczyć różnymi stopniami autofosforylacji wariantów transkrypcyjnych.
Poliadenylacja
Na podstawie analizy oprogramowania sekwencji mRNA można było zidentyfikować różne wzorce poliadenylacji dla wariantów transkrypcji. TV1 i TV2 mają ten sam wzór zlokalizowany w eksonie 10, zaczynając od pozycji 1246, co skutkuje motywem 32 nukleotydów (AGUAGAGUCUGCGCUGUGACCUUCUGUUGGGC). TV3 wykorzystuje motyw na eksonie 11 w pozycji 320. Motyw ma również długość 32 nukleotydów, ale różni się od sekwencji używanej przez TV1/2 (AGUGGCUUGUUCCACCUCAGCUCCCAUCUAAC). Różnica w sekwencji poliadenylacji powoduje zmienność minimalnych wartości energii swobodnej przewidywanych struktur fałdowania RNA (-28,70 kcal/mol, TV1 i TV2 oraz -16,03 kcal/mol, TV3), co może skutkować różną długością Ogon poli-A. Opierając się na obserwacji, że stabilne struktury drugorzędowe skutkują zmniejszoną poliadenylacją określonego miejsca, może to wskazywać, że TV1 i TV2 są mniej poliadenylowane w porównaniu z TV3.
Struktura

Podobnie jak eukariotyczne kinazy białkowe (ePK), różne izoformy z rodziny CK1 składają się z płata N-końcowego i C-końcowego (odpowiednio płata N i C), które są połączone regionem zawiasowym. Podczas gdy płat N składa się głównie z pasm β-arkuszy, większy płat C składa się głównie ze struktur α-helikalnych i pętli. Pomiędzy obydwoma płatami tworzy się szczelina katalityczna, w której znajdują się substraty i ATP do reakcji kinazy.
Wiązanie substratów i kosubstratów
Wiązanie fosforylowanych substratów z różnymi regionami płata C zostało wcześniej wykryte przez wiązanie pochodnej wolframianu (jako analogu fosforanu). Zamiast substratu aktywowanego fosfo również C-końcowa domena regulatorowa CK1δ jest zdolna do wiązania się z tą pozycją w celu funkcji autoregulacji. Wiązanie ATP odbywa się głównie za pośrednictwem bogatej w glicynę pętli P (L-12, łączące nici β1 i β2), tworzącej górną pokrywę miejsca wiązania WTP oraz tak zwanej pętli katalitycznej (L-67). Zmiany konformacyjne wpływające na pętlę aktywacyjną (L-9D) są związane z regulacją aktywności kinazy. Kiedy pętla aktywacyjna przesuwa się z miejsca katalitycznego, katalitycznie istotny motyw DFG (Asp-149, Phe-150 i Gly-151) przesuwa się do pozycji wewnętrznej. Reszta asparaginianu chelatuje jon Mg 2+ , umożliwiając właściwe wiązanie i orientację ATP. Inną resztą, która jest zasadniczo zaangażowana w regulację aktywności kinazy, ale także w tworzenie interakcji z drobnocząsteczkowymi inhibitorami, jest Met-82, tzw. reszta gatekeepera. Znajdująca się bezpośrednio w kieszeni wiążącej ATP reszta ta kontroluje dostęp małych cząsteczek do pewnych kieszeni wiążących (kieszonek selektywności) znajdujących się poza pozycją strażnika.
Dodatkowe domeny funkcjonalne
Oprócz domen bezpośrednio zaangażowanych w aktywność katalityczną w białku CK1δ obecne są dalsze domeny funkcjonalne. W domenie kinazy można znaleźć domenę homologii kinezyny (KHD), jak również domniemaną domenę dimeryzacji (DD). Podczas gdy KHD umożliwia CK1 interakcję ze składnikami cytoszkieletu. DD ma być zaangażowany w regulację kinazy (patrz poniżej). Ponadto w płacie C można znaleźć sygnał lokalizacji jądrowej (NLS), jak również sygnał lokalizacji centrosomu (CLS). Jednak pierwszy nie wystarcza do zlokalizowania CK1δ w jądrze.
Regulacja ekspresji i aktywności
Rygorystyczna kontrola ekspresji CK1δ i aktywności kinazy ma kluczowe znaczenie ze względu na jej udział w ważnych komórkowych szlakach transdukcji sygnału. Zasadniczo podstawowe poziomy ekspresji CK1δ różnią się w zależności od różnych tkanek, typów komórek i warunków fizjologicznych. Zwiększone poziomy ekspresji mRNA CK1δ można wykryć po traktowaniu komórek substancjami uszkadzającymi DNA, takimi jak etopozyd i kamptotecyna, lub przez napromieniowanie γ, podczas gdy zwiększoną aktywność specyficzną dla CK1 obserwuje się po stymulacji komórek insuliną lub po transformacji wirusowej.
Sekwestracja subkomórkowa
Na poziomie białka , aktywność CK1δ może być regulowana przez sekwestrację do poszczególnych przedziałów subkomórkowych, łączących kinazę z odrębnymi pulami substratów w celu kierowania jej funkcją komórkową. Ta sekwestracja jest zwykle ułatwiona przez białka rusztowania, które mają również allosterycznie kontrolować aktywność wchodzącej w interakcje kinazy. Opisano, że w sekwestracji subkomórkowej CK1δ pośredniczy białko kotwiczące kinazy A (AKAP) 450, połączona z chromosomem X helikaza RNA DEAD-box 3 (DDX3X), białko wiążące kinazę kazeinową-1 (CK1BP) oraz regulacyjne i złożone -cząsteczka budująca/-inicjująca 14-3-3 ζ. AKAP450 rekrutuje CK1δ i ε do centrosomu w celu wykonywania funkcji specyficznych dla centrosomu w kontekście regulacji cyklu komórkowego. DDX3X promuje fosforylację Disheveled (Dvl) za pośrednictwem CK1ε w kanonicznym szlaku Wnt, ale wykazano również, że stymuluje aktywność kinaz specyficznych dla CK1δ i ε nawet o pięć rzędów wielkości. Przeciwnie, białka homologiczne do CK1BP (np. dysbindyna lub BLOC-1 [biogeneza kompleksu 1 organelli związanych z lizosomami]) są zdolne do hamowania aktywności kinazy CK1δ w sposób zależny od dawki.
Dimeryzacja
Dimeryzacja CK1δ została również opisana jako mechanizm regulacyjny poprzez interfejs interakcji zawarty w DD CK1δ. Po dimeryzacji Arg-13 wstawia się do kieszeni wiążącej adeninę i zapobiega wiązaniu ATP i być może także dużych substratów. Chociaż CK1δ w roztworze jest zawsze oczyszczany jako monomery, biologiczne znaczenie dimeryzacji można wykazać, wykazując, że wiązanie dominującego negatywnego mutanta CK1δ z CK1δ typu dzikiego spowodowało całkowite zmniejszenie aktywności kinazy specyficznej dla CK1δ.
Fosforylacja specyficzna dla miejsca

Wykazano, że modyfikacje potranslacyjne, w szczególności fosforylacja specyficzna dla miejsca, w której pośredniczą kinazy poprzedzające lub autofosforylacja wewnątrzcząsteczkowa, odwracalnie modulują aktywność kinazy CK1δ. Kilka reszt w C-końcowej domenie regulatorowej CK1δ zidentyfikowano jako cele autofosforylacji, w tym Ser-318, Thr-323, Ser-328, Thr-329, Ser-331 i Thr-337. Po autofosforylacji generowane są motywy sekwencji w domenie C-końcowej, które są zdolne do blokowania centrum katalitycznego kinazy, działając jako pseudosubstrat. Funkcja regulacyjna domeny C-końcowej została ponadto potwierdzona przez obserwację, że aktywność kinazy wzrasta po proteolitycznym rozszczepieniu tej domeny.
Oprócz autofosforylacji wykazano, że fosforylacja specyficzna dla miejsca przez inne kinazy komórkowe reguluje aktywność kinazy. Dotychczas potwierdzono C-końcową fosforylację CK1δ przez kinazy poprzedzające kinazę białkową A (PKA), kinazę białkową B (Akt), kinazę cyklinozależną 2/cyklinę E (CDK2/E) i kinazę cyklinozależną 5/ p35 (CDK5/p35), kinaza podobna do CDC 2 (CLK2), kinaza białkowa Cα (PKCα) i kinaza punktu kontrolnego 1 (Chk1). W przypadku kilku zdarzeń fosforylacji opisano również wpływ na funkcję kinazy. Dla reszty Ser-370, która może być fosforylowana co najmniej przez PKA, Akt, CLK2, PKCα i Chk1, wykazano główną funkcję regulacyjną. W konsekwencji zmienionej aktywności kinazy mutanta CK1δ S370A, następnie zaburzona transdukcja sygnału Wnt/β-katenina spowodowała rozwój ektopowej osi grzbietowej w zarodkach Xenopus laevis . Dalsze reszty, na które ukierunkowana jest fosforylacja specyficzna dla miejsca, przedstawiono na Figurze 2. Mutacja zidentyfikowanych miejsc docelowych do nieulegającego fosforylacji aminokwasu alaniny prowadzi w większości przypadków do znaczącego wpływu na parametry katalityczne CK1δ, przynajmniej in vitro .
Dowody uzyskano również w analizach opartych na hodowlach komórkowych, które wykazały zmniejszoną aktywność kinazy specyficznej dla CK1 po aktywacji komórkowej Chk1 i zwiększoną aktywność CK1 po potraktowaniu komórek specyficznym dla PKC inhibitorem Gö-6983 lub pan- inhibitorem CDK dinaciclibem . Odkrycia te wskazują, że fosforylacja specyficzna dla miejsca, w której pośredniczą Chk1, PKCα i CDK, w rzeczywistości skutkuje zmniejszoną aktywnością komórkowej kinazy specyficznej dla CK1. Jednak w większości przypadków brakuje solidnych danych dotyczących fosforylacji in vivo , a biologiczne znaczenie i funkcjonalne konsekwencje fosforylacji specyficznej dla miejsca wymagają zbadania w warunkach in vivo . Ponadto docelowe miejsca fosforylacji w domenie kinazy nie zostały jeszcze dokładnie scharakteryzowane i są przedmiotem przyszłych badań.
Podłoża
Jak dotąd zidentyfikowano ponad 150 białek, które są celami fosforylacji za pośrednictwem CK1, przynajmniej in vitro . Fosforylacja wielu substratów jest możliwa dzięki istnieniu kilku motywów konsensusowych, które można rozpoznać po izoformach CK1 .
Kanoniczny motyw konsensusu
CK1δ korzystnie oddziałuje z substratami naładowanymi fosforem lub kwaśnymi z powodu lokalizacji dodatnio naładowanych aminokwasów (np. Arg-178 i Lys-224) w regionie zaangażowanym w rozpoznawanie substratu. Kanoniczny motyw konsensusu, na który celuje CK1 , jest reprezentowany przez sekwencję pSer/pThr-XX-(X)-Ser/Thr. W tym motywie X oznacza dowolny aminokwas, podczas gdy pSer/pThr oznacza uprzednio fosforylowaną resztę seryny lub treoniny. Fosforylacja, w której pośredniczy CK1, zachodzi w Ser / Thr poniżej reszty fosforanowej. Jednakże, zamiast primowanej reszty, kanoniczny motyw konsensusu może zawierać również skupisko ujemnie naładowanych reszt aminokwasowych (Asp lub Glu).
Niekanoniczny motyw konsensusu
Jako pierwszy niekanoniczny motyw konsensusowy namierzony przez CK1δ opisano tak zwany motyw SLS (Ser-Leu-Ser), który można znaleźć w β-kateninie i czynniku jądrowym aktywowanych komórek T (NFAT). W kilku białkach wiążących sulfatydy i 3-siarczany cholesterolu (SCS) zidentyfikowano motyw konsensusowy Lys/Arg-X-Lys/Arg-XX-Ser/Thr i wykazano fosforylację tego motywu dla podstawowego białka mieliny (MBP ), członek rodziny homologów Ras A (RhoA) i tau.
Lokalizacja subkomórkowa
W żywych komórkach CK1δ można wykryć zarówno w cytoplazmie, jak i jądrze, a podwyższone poziomy CK1δ można znaleźć w bliskim sąsiedztwie aparatu Golgiego i sieci trans Golgiego (TGN). Tymczasowo CK1δ może być również zlokalizowana w błonach, receptorach, pęcherzykach transportowych, składnikach cytoszkieletu, centrosomach czy biegunach wrzeciona. Chociaż obecny NLS nie jest wystarczający do jądrowej lokalizacji CK1δ, obecność domeny kinazy, a nawet jej aktywność enzymatyczna są potrzebne do właściwej lokalizacji subkomórkowej CK1δ.
Interakcja z białkami komórkowymi
Lokalizacja CK1δ w pewnych przedziałach subkomórkowych może być ponadto inicjowana przez jego interakcję z białkami komórkowymi. Aby pośredniczyć w interakcji z CK1δ, odpowiednie motywy dokujące muszą być obecne w odpowiednich białkach. Motyw dokowania Phe-XXX-Phe został zidentyfikowany w NFAT, β-kateninie, PER i białkach z rodziny FAM83. Na przykład jądrowy CK1δ można zlokalizować w plamkach jądrowych poprzez jego oddziaływanie z FAM83H. Inny motyw interakcji jest reprezentowany przez sekwencję Ser-Gln-Ile-Pro, która jest obecna w białku wiążącym plus-koniec 1 (EB1) mikrotubuli. W ostatnich latach opisano wielu partnerów interakcji dla CK1δ, tworzących silne interakcje z CK1δ, a zatem będących czymś więcej niż prostymi białkami substratowymi. Jak wspomniano powyżej, wykazano interakcje z CK1δ dla AKAP450 i DDX3X. Poprzez wstępne wykonanie dwuhybrydowych badań przesiewowych drożdży można również potwierdzić interakcję białka wiążącego Ran w centrum organizacji mikrotubul (RanBPM), białka 1A związanego z mikrotubulami i snapiny, białka związanego z uwalnianiem neuroprzekaźników w komórkach neuronalnych. Interakcje z CK1δ wykryto również dla związanych z rozwojem czynników LEF-1 (czynnik wzmacniający limfocyty-1) i proneuralnego podstawowego czynnika transkrypcyjnego helisa-pętla-helisa (bHLH) Atoh1. Wreszcie wykazano interakcję CK1δ z białkami zegara okołodobowego PER i CRY, ułatwiając translokację jądrową PER i CRY.
Funkcje komórkowe
Rytm okołodobowy
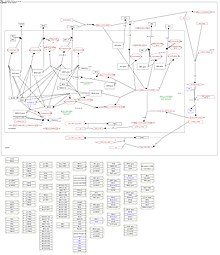
Wydaje się, że CK1δ bierze udział w rytmie okołodobowym, wewnętrznym zegarze komórkowym, który pozwala na rytm około 24-godzinny. Rytm okołodobowy składa się głównie z pętli ujemnego sprzężenia zwrotnego, w której pośredniczą białka (PER) i kryptochrom (CRY), które mogą dimeryzować i przemieszczać się do jądra. Tutaj dimery PER / CRY mogą hamować własną transkrypcję, hamując transkrypcję genu reagującego na CLOCK / BMAL1. Zmianę prawidłowego rytmu okołodobowego obserwowano w różnych chorobach, między innymi w zaburzeniach neurologicznych i zaburzeniach snu. W jądrze CK1δ może dalej hamować transkrypcję sterowaną przez CLOCK / BMAL1 poprzez zmniejszanie ich aktywności wiązania z DNA. Ponadto CK1δ/ε może fosforylować białka PER i wpływać na ich dalszą degradację. Destabilizację rytmu okołodobowego można zaobserwować po zahamowaniu fosforylacji PER przez CK1δ/ε. W rzeczywistości zmiany w aktywności CK1δ prowadzą do zmian w długości rytmu okołodobowego.
Uszkodzenie DNA i stres komórkowy
CK1δ może być również aktywowany przez stres genotoksyczny i uszkodzenie DNA w sposób zależny od p53 i fosforylować kluczowe białka regulatorowe w odpowiedzi na te procesy. CK1δ fosforyluje ludzki p53 na Ser-6, Ser-9 i Ser-20. Co więcej, CK1δ fosforyluje p53 na Thr-18, gdy p53 jest już aktywowany fosforem, co pozwala na niższe wiązanie p53-Mdm2 i wyższą aktywność p53. W normalnych warunkach CK1δ może fosforylować Mdm2 na Ser-240, Ser-242, Ser-246 i Ser-383, umożliwiając wyższą stabilność p53-Mdm2 i dalszą degradację p53. Przeciwnie, po uszkodzeniu DNA, ATM fosforyluje CK1δ, który następnie może fosforylować Mdm2 indukując jego degradację proteasomalną. W warunkach niedotlenienia CK1δ bierze udział w zmniejszaniu proliferacji komórek poprzez zakłócanie tworzenia kompleksu HIF-1α/ARNT. Dodatkowo aktywność topoizomerazy II α (TOPOII-α), jednego z głównych regulatorów replikacji DNA, wzrasta po jej fosforylacji za pośrednictwem CK1δ na Ser-1106. W warunkach stresowych CK1δ może zakłócać replikację DNA. W rzeczywistości CK1δ fosforyluje główny regulator metylacji DNA, białko podobne do ubikwityny zawierające domeny PHD i RING finger 1 (UHRF1), na Ser-108, zwiększając jego degradację w proteasomach.
Cykl komórkowy, mitoza i mejoza
CK1δ bierze udział w dynamice mikrotubul, progresji cyklu komórkowego, stabilności genomu, mitozie i mejozie. Przejściowe zatrzymanie mitozy można zaobserwować po zahamowaniu CK1δ za pomocą IC261, mimo że ostatnio wykazano, że ten inhibitor nie jest specyficzny dla CK1 i ma wiele dodatkowych celów poza celem Niemniej jednak, zgodnie z tymi wynikami, hamowanie lub wyciszanie CK1δ pozwala na stabilność Wee1 i późniejsza fosforylacja Cdk1, która umożliwia wyjście z cyklu komórkowego. Brak CK1δ był również związany z niestabilnością genomu. Niemniej jednak rola CK1δ w mitozie jest nadal niejasna i opublikowano przeciwne doniesienia.
Wydaje się, że CK1δ bierze również udział w mejozie. Hrr25, ortolog CK1δ w Saccharomyces cerevisiae , można znaleźć w ciałach P – granulkach RNA/białka zidentyfikowanych w cytoplazmie komórek mejotycznych – i wydaje się, że jest niezbędny do progresji mejozy. Ponadto zaobserwowano, że Hrr25 odgrywa rolę w podziale jądrowym i syntezie błon podczas mejozy II. U Schizosaccharomyces pombe ortolog CK1δ/ε Hhp2 promuje rozszczepianie białka kohezyjnego Rec8 prawdopodobnie po jego fosforylacji podczas mejozy. Ponadto można było zaobserwować fosforylację STAG3, ssaczego ortologu Rec11, przez CK1, co potwierdza możliwą konserwację tego procesu również u ssaków.
Funkcje związane z cytoszkieletem
CK1δ bierze udział w regulacji polimeryzacji mikrotubul i stabilności aparatu wrzeciona i centrosomów podczas mitozy poprzez bezpośrednią fosforylację α-, β- i γ-tubuliny. Ponadto CK1δ może również fosforylować białka związane z mikrotubulami (MAP), wpływając w ten sposób na ich oddziaływanie z mikrotubulami, jak również na dynamikę mikrotubul.
Ścieżki rozwojowe

CK1δ bierze udział w różnych ścieżkach rozwojowych, między innymi w ścieżkach Bezskrzydłych (Wnt), Hedgehog (Hh) i Hippo (Hpo). W szlaku Wnt CK1δ może fosforylować różne czynniki szlaku, między innymi Disheveled (Dvl), Aksynę, APC i β-kateninę. CK1δ również negatywnie wpływa na stabilność β-kateniny po jej fosforylacji na Ser-45, co umożliwia dalszą fosforylację za pośrednictwem GSK3β i późniejszą degradację.

W szlaku Hh CK1δ może fosforylować Smothened (Smo), zwiększając w ten sposób swoją aktywność. Co więcej, jego dodatkowa rola w tych szlakach sygnałowych jest nadal kontrowersyjna. W rzeczywistości z jednej strony CK1δ może fosforylować aktywator Cubitus interruptus (CiA), unikając w ten sposób jego degradacji w proteasomach, podczas gdy z drugiej strony fosforylacja Ci za pośrednictwem CK1δ może zwiększyć jego ubikwitynację i częściową proteolizę do represyjnej postaci Ci (CiR).
W szlaku Hpo CK1δ może fosforylować białko związane z tak (YAP), koaktywator w dół transkrypcji genu reagującego na Hpo na Ser-381, co wpływa na jego degradację w proteasomach. Co więcej, szlak sygnałowy Hpo wydaje się być powiązany z obydwoma sygnałami Wnt. i regulacja p53 W obecności ligandu Wnt, CKδ/ε może fosforylować kluczowy efektor Wnt Disheveled (Dvl), który hamuje kompleks destrukcyjny β-kateniny, co ostatecznie skutkuje wyższą stabilnością β-kateniny. Tutaj YAP / Tafazzin (TAZ) może wiązać Dvl i zmniejszać jego fosforylację, w której pośredniczy CK1δ. Dodatkowo β-katenina może być zatrzymywana w cytoplazmie po związaniu z YAP, co skutkuje niższą transkrypcją genów reagujących na Wnt.
Znaczenie kliniczne
W tej sekcji omówiona zostanie funkcja CK1δ w występowaniu, rozwoju i postępie kilku chorób i zaburzeń, głównie nowotworów, chorób neurologicznych i chorób metabolicznych.
rakotwórczość
Deregulacja CK1δ przyczynia się do powstawania nowotworów i progresji nowotworu poprzez deregulację sygnalizacji związanej z Wnt / β-kateniny, p53, Hedgehog i Hippo. mRNA CK1δ ulega nadekspresji w różnych nowotworowych , między innymi w raku pęcherza, raku mózgu, raku piersi, raku jelita grubego, raku nerki, gruczolakoraku płuc, czerniaku, raku jajnika, raku trzustki, raku prostaty, nowotworach układu krwiotwórczego i nowotworach układu limfatycznego. Obniżone poziomy ekspresji mRNA CK1δ obserwowano również w niektórych badaniach nad nowotworami, takimi jak rak pęcherza moczowego, rak płaskonabłonkowy płuc, rak żołądka, rak nerki, rak przełyku, a także rak głowy i szyi. Poza tym, zmniejszona aktywność CK1δ dzięki mutacji miejsca N172D CK1δ spowolniła progresję raka sutka i wydłużyła przeżycie myszy w transgenicznym modelu myszy. Dwie mutacje CK1δ, R324H i T67S, zidentyfikowane odpowiednio w błonie śluzowej jelita i guzie jelita grubego, wykazują zwiększony potencjał rakotwórczy.
Neuropatie i choroby neurologiczne
Nieprawidłową ekspresję CK1δ w tkance mózgowej stwierdzono w wielu chorobach za pomocą badań immunohistochemicznych i badań nad ekspresją genów, takich jak choroba Alzheimera (AD), zespół Downa (DS), postępujące porażenie nadjądrowe (PSP), zespół otępienia parkinsonowskiego Guama (PDC), choroba Picka (PiD), zwyrodnienie pallido-mostowo-czarne (PPND) i rodzinny zespół zaawansowanej fazy snu (FASPS).
W typowych tkankach patologicznych blaszki neurytyczne (NPs) lub ciałka zwyrodnieniowe ziarnistych pęcherzyków żółciowych (GVB) AD wykazują wysoką ekspresję CK1δ, podczas gdy w splątkach neurofibrylarnych (NFT) ekspresja CK1δ jest niska. Białka charakterystyczne dla AD tau w NFT lub GVB i białko wiążące DNA TAR o masie 43 kDa (TDP-43) w GVB kolokalizują się z CK1δ. in vitro wykazały, że kilka miejsc w tau i TDP-43 było fosforylowanych przez CK1δ. Redukcja miejscowo-specyficznej fosforylacji TDP-43 poprzez hamowanie CK1δ zarówno w modelu komórek neuronalnych, jak iw modelu Drosophila skutkowała zapobieganiem neurotoksyczności, aw konsekwencji ratowaniem komórek przed śmiercią komórkową. Na podstawie tych badań CK1δ można by uznać za cechę charakterystyczną, a także potencjalny cel leczenia AD i może być dalej przydatny do celów diagnostycznych i terapeutycznych w przyszłości. Ponadto CK1δ odgrywa rolę regulacyjną w chorobie Parkinsona (PD) poprzez fosforylację α-synukleiny. Rodzinny zespół zaawansowanej fazy snu (FASPS) to kolejna choroba neurologiczna związana z fosforylacją białka zegarowego ssaków PER2, w której pośredniczy CK1δ. Po specyficznej miejscowo fosforylacji przez CK1δ stabilność PER2 zwiększa się, a okres półtrwania PER2 wydłuża się. Ponadto na stabilność PER2 może wpływać mutacja CK1δ T344A i specyficzna miejscowo fosforylacja CK1δ w Thr-347 przez inne kinazy wewnątrzkomórkowe.
CK1δ może wpływać na dysfunkcję metaboliczną, zwłaszcza u osób otyłych, poprawiając tolerancję glukozy, zmniejszając ekspresję genów glukoneogenezy i wydzielanie glukozy lub zwiększając podstawowy i stymulowany insuliną wychwyt glukozy. Ponadto tworzenie biologicznie aktywnej postaci adiponektyny o wyższej masie cząsteczkowej (HMW), która bierze udział w regulacji poziomu glukozy i kwasów tłuszczowych wydzielanych z tkanki tłuszczowej, jest modulowane przez miejscowo specyficzną fosforylację adiponektyny przez CK1δ.
Pasożytnicze CK1 przejmują szlaki CK1 ssaków
Coraz więcej dowodów sugeruje, że CK1 może być powiązany z chorobami zakaźnymi poprzez manipulację szlakami sygnalizacyjnymi związanymi z CK1 w komórce gospodarza przez wewnątrzkomórkowe pasożyty , eksportując ich CK1 do komórki gospodarza. W przypadku Leishmania i Plasmodium wydalana CK1 przyczynia się do przeprogramowania odpowiednich komórek gospodarza. Posiadając funkcje żywiciela, pasożytnicze CK1 są w stanie zastąpić CK1 ssaków, zapewniając w ten sposób podobne funkcje. Pasożytnicze CK1 wykazują wysoki poziom identyczności z ludzkim CK1δ TV1, co sugeruje, że ten ludzki paralog może być preferowanym celem porwania przez pasożyty. Organizacja białek pasożytniczych CK1 jest bardzo podobna do ludzkiej CK1δ. Wszystkie reszty zaangażowane w wiązanie ATP, reszta strażnika, jak również motywy DFG, KHD i SIN są generalnie konserwowane w pasożytniczych sekwencjach CK1. To odkrycie sugeruje, że są one kluczowe dla funkcji CK1. Jednak funkcje tych kinaz w pasożytach i, co ważniejsze, ich funkcje w komórce gospodarza są głównie nieznane i pozostają do zbadania. CK1 z Plasmodium i Leishmania są najczęściej badane:
- Jedyny CK1 w Plasmodium , PfCK1 (PF3D7_1136500), wykazuje 69% identyczności z ludzkim CK1 w domenie kinazy i jest niezbędny do zakończenia bezpłciowego cyklu wewnątrzerytrocytowego. Podobnie jak inne CK1, również PfCK1 ma wielu partnerów wiążących, a zatem potencjalnie reguluje wiele szlaków, w tym te regulujące transkrypcję, translację i handel białkami. Wreszcie, PfCK1 wydaje się być niezbędny do proliferacji pasożytów w erytrocytach.
- Z sześciu paralogów CK1 w Leishmania donovani tylko dwa paralogi, LdBPK_351020.1 i LdBPK_351030.1 (LmCK1.2), są blisko spokrewnione z ludzkim CK1. Jedyny paralog opisany jako pełniący funkcję w komórce gospodarza. LdBPK_351030.1 jest aktywny zarówno u promastigotów, jak i amastigotów. LmCK1.2 może być hamowany przez specyficzny dla CK1 inhibitor D4476 i jest ważny dla przeżycia wewnątrzkomórkowego pasożyta. Jak dotąd zidentyfikowano tylko kilka substratów dla LmCK1.2, a funkcje LmCK1.2 u pasożyta są słabo zbadane. Chociaż LmCK1.2 jest wysoce identyczny z ludzkim CK1, zidentyfikowano kilka małych cząsteczek, które specyficznie celują w Leishmania CK1, zapewniając w ten sposób możliwości nowych strategii terapeutycznych.
Modulowanie aktywności CK1δ
Ze względu na fakt, że CK1δ bierze udział w regulacji różnych procesów komórkowych, podejmuje się wiele prób wpływania na jego aktywność. Ponieważ zmiany ekspresji i/lub aktywności oraz występowanie mutacji w obrębie sekwencji kodującej CK1δ odpowiadają za rozwój różnych chorób, w tym raka i chorób neurodegeneracyjnych, takich jak AD, ALS, PD i zaburzenia snu, największe zainteresowanie koncentruje się na opracowaniu specyficznych dla CK1δ inhibitorów drobnocząsteczkowych (SMI). Ze względu na fakt, że mutanty CK1δ izolowane z różnych jednostek nowotworowych często wykazują wyższy potencjał onkogenny niż CK1δ typu dzikiego, podejmowane są również duże wysiłki w celu wytworzenia SMI, które są bardziej selektywnie hamujące mutanty CK1δ niż CK1δ typu dzikiego. Te SMI miałyby duże znaczenie kliniczne, ponieważ zwiększyłyby okno terapeutyczne i zmniejszyły terapeutyczne skutki uboczne w leczeniu chorób proliferacyjnych i neurodegeneracyjnych. Jednak opracowanie specyficznych inhibitorów CK1δ jest bardzo trudne z kilku powodów: (i) Jak dotąd większość opracowanych inhibitorów sklasyfikowano jako inhibitory współzawodniczące z ATP, wykazujące efekty niecelowe, głównie z powodu podobieństw strukturalnych miejsca wiązania ATP CK1δ do tych innych kinaz i białek wiążących ATP, (ii) specyficzna miejscowo fosforylacja CK1δ, zwłaszcza w obrębie jej C-końcowej domeny regulatorowej, często zwiększa wartość IC50 specyficznych inhibitorów CK1δ oraz (iii) ze względu na ich hydrofobowy charakter ich biodostępność jest często bardzo niski. W ciągu ostatnich kilku lat opisano kilka SMI o znacznie wyższej selektywności w stosunku do CK1δ niż w stosunku do innych izoform CK1 , które są również skuteczne w modelach zwierzęcych. Leczenie szczurów, myszy, małp i danio pręgowanego za pomocą PF-670462 (4-[3-cykloheksylo-5-(4-fluoro-fenylo)-3H-imidazol-4-ilo]-pirymidyn-2-yloaminy) powoduje fazę zmiana rytmu okołodobowego. Ponadto blokuje ruchliwość indukowaną amfetaminą u szczurów, zapobiega efektowi deprywacji alkoholu u szczurów i hamuje ostre i przewlekłe zwłóknienie płuc wywołane bleomycyną u myszy. PF-670462 zatrzymuje również pogorszenie spowodowane napromieniowaniem oczu UVB w mysim modelu wrzodziejącego zapalenia jelita grubego i zmniejsza gromadzenie się komórek białaczkowych we krwi obwodowej i śledzionie w mysim modelu przewlekłej białaczki limfatycznej (CLL). Wykazano, że PF-5006739 , pochodna 4-[4-(4-fluorofenylo)-1-(piperydyn-4-ylo)-1H-imidazol-5-ilo]pirymidyn-2-aminy osłabia zachowanie związane z poszukiwaniem narkotyków opioidowych u gryzoni. Ponadto prowadzi to do opóźnienia fazy rytmu okołodobowego w nocnych i dziennych modelach zwierzęcych. Pochodne N-benzotiazolilo-2-fenyloacetamidu opracowane przez Salado i współpracowników wykazują działanie ochronne na in vivo hTDP-43 u Drosophila .
Co ciekawe, inhibitory produkcji Wnt (IWP), o których wiadomo, że hamują O-acylotransferazę jeżozwierza (Porcn) i są antagonistami szlaku Wnt, wykazują podobieństwa strukturalne do opartych na benzimidazolu inhibitorów CK1, w tym Bischof-5, a zatem są bardzo silne w swoiście hamując CK1δ. Dalszy rozwój pochodnych IWP zaowocował ulepszonymi inhibitorami CK1δ opartymi na IWP, współzawodniczącymi z ATP. Podsumowując, można stwierdzić, że efekty komórkowe, w których pośredniczą IWP, wynikają nie tylko z hamowania Porcn, ale także z hamowania szlaków sygnałowych zależnych od CK1δ. Dane te wyraźnie wskazują na wysoki potencjał specyficznych inhibitorów CK1δ w spersonalizowanych koncepcjach terapii w leczeniu różnych jednostek nowotworowych (np. raka piersi, raka jelita grubego i glejaka), białaczki, chorób neurodegeneracyjnych, takich jak AD, PD i AL, oraz zaburzeń snu. Ponadto wydaje się, że specyficzne inhibitory CK1δ wykazują duże znaczenie w zastosowaniach prognostycznych. W tym kontekście można wykazać, że znakowane [ 11C ] difluoro-dioksolo-benzoimidazolo-benzamidy o silnym działaniu mogą być stosowane jako radioznaczniki PET i do obrazowania AD.
Ponieważ inhibitory małocząsteczkowe często mają różne wady, w tym niską biodostępność, skutki poza celem, jak również poważne skutki uboczne, zainteresowanie rozwojem i walidacją nowych narzędzi biologicznych, takich jak identyfikacja biologicznie aktywnych peptydów zdolnych do hamowania aktywności CK1δ lub interakcji CK1δ z białkami komórkowymi stale rośnie. Wykorzystanie bibliotek peptydów zaowocowało identyfikacją peptydów zdolnych do swoistego blokowania interakcji CK1δ z tubuliną, helikazą RNA DDX3X i Aksyną. Wiązanie peptydu δ-361 z α-tubuliną nie tylko prowadzi do zablokowania interakcji CK1δ z α-tubuliną, ale także selektywnie hamuje fosforylację GST-α-tubuliny przez CK1δ. Traktowanie nowotworowych peptydem δ-361 ostatecznie doprowadziło do destabilizacji mikrotubul i śmierci komórki. Zidentyfikowano dokładne mapowanie domen interakcji DDX3X na CK1δ, peptydach CK1δ δ-1 i δ-41, aby móc blokować interakcje CK1δ z połączoną z chromosomem X helikazą RNA DEAD box DDX3X, jak również aktywność kinazy CK1δ. Ponadto te dwa zidentyfikowane peptydy mogą hamować stymulację CK1 w ustalonych liniach komórkowych. Ponieważ mutacje DDX3X obecne u pacjentów z rdzeniakiem zwiększają aktywność CK1 w żywych komórkach, a następnie aktywują szlaki regulowane przez CK1, takie jak Wnt / β-katenina i sygnalizacja hedgehog, zidentyfikowane peptydy blokujące interakcje mogą być przydatne w spersonalizowanych koncepcjach terapii w leczeniu nowotworów napędzanych przez Wnt/β-kateninę lub Hedgehog. W 2018 roku interakcja między Axin1, białkiem rusztowania wykazującym ważne role w sygnalizacji Wnt, a CK1δ / ε została dokładnie zmapowana przy użyciu biblioteki peptydów. Zidentyfikowane peptydy pochodzące z Axin1 były zdolne do blokowania interakcji z CK1δ/ε. Ponieważ Axin1 i Dvl konkurują również o fosforylację specyficzną dla miejsca, w której pośredniczy CK1δ / ε, można stwierdzić, że Aksyna 1 odgrywa ważną rolę w równoważeniu fosforylacji Dvl, w której pośredniczy CK1δ / ε, jak również w aktywacji kanonicznej sygnalizacji Wnt.
Zobacz też
Notatki
Linki zewnętrzne
- Lokalizacja ludzkiego genomu CSNK1D i strona szczegółów genu CSNK1D w przeglądarce genomu UCSC .
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P48730 (izoforma delta ludzkiej kinazy kazeinowej) w PDBe-KB .
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : Q9DC28 (mysia kinaza kazeinowa I izoforma delta) w PDBe-KB .







