Gamma-syntaza cystationiny
| gamma-syntaza cystationiny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 gamma-syntaza cystationiny homotetramer, Helicobacter pylori
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 2.5.1.48 | ||||||||
| nr CAS | 9030-70-0 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
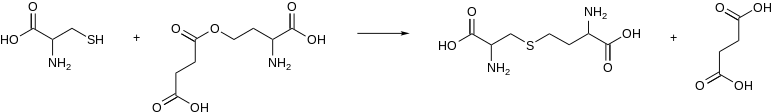
W enzymologii gamma-syntaza cystationiny ( EC 2.5.1.48 ) jest enzymem , który katalizuje tworzenie cystationiny z cysteiny i aktywowanej pochodnej homoseryny , np.:
W mikroorganizmach aktywowanym substratem tego enzymu jest O4-sukcynylo-L-homoseryna lub O4-acetylo-L-homoseryna. Gamma-syntaza cystationiny z roślin wykorzystuje zamiast tego fosforan L-homoseryny.
Enzym ten należy do rodziny transferaz , w szczególności przenoszących grupy arylowe lub alkilowe inne niż grupy metylowe. Systematyczna nazwa tej klasy enzymów to O4-sukcynylo-L-homoseryna:L-cysteina S-(3-amino-3-karboksypropylo)transferaza . Inne powszechnie stosowane nazwy to liaza bursztynianowa O-sukcynylo-L-homoseryny (z dodatkiem cysteiny) , liaza O-sukcynylohomoseryny (tiol) , O-transsukcynylaza homoseryny , syntaza O-sukcynylohomoseryny , syntetaza O-sukcynylohomoseryny , syntaza cystationiny , syntetaza cystationiny , transsukcynylaza homoseryny , 4-O-sukcynylo-L-homoseryna:L-cysteina i S-(3-amino-3-karboksypropylo)transferaza . Enzym ten uczestniczy w 4 szlakach metabolicznych : metabolizm metioniny , metabolizm cysteiny , metabolizm selenoaminokwasów i metabolizm siarki . Wykorzystuje jeden kofaktor , fosforan pirydoksalu .
- Flavin M, Ubój C (marzec 1967). „Enzymatyczna synteza homocysteiny lub metioniny bezpośrednio z O-sukcynylo-homoseryny”. Biochimica et Biophysica Acta . 132 (2): 400–5. doi : 10.1016/0005-2744(67)90158-1 . PMID 5340123 .
- Kaplan MM, Flavin M (październik 1966). „Gama-syntetaza cystationiny Salmonelli. Właściwości katalityczne nowego enzymu w bakteryjnej biosyntezie metioniny” . Journal of Biological Chemistry . 241 (19): 4463–71. doi : 10.1016/S0021-9258(18)99743-7 . PMID 5922970 .
- Wiebers JL, Garner HR (styczeń 1967). „Syntetazy homocysteiny i cysteiny Neurospora crassa. Oczyszczanie, właściwości i kontrola aktywności ze sprzężeniem zwrotnym” . Journal of Biological Chemistry . 242 (1): 12–23. doi : 10.1016/S0021-9258(18)96312-X . PMID 6016326 .
- Wiebers JL, Garner HR (grudzień 1967). „Acylowe pochodne homoseryny jako substraty do syntezy homocysteiny w Neurospora crassa, drożdżach i Escherichia coli” . Journal of Biological Chemistry . 242 (23): 5644–9. doi : 10.1016/S0021-9258(18)99405-6 . PMID 12325384 .
- Clausen T, Huber R, Prade L, Wahl MC, Messerschmidt A (grudzień 1998). „Struktura krystaliczna gamma-syntazy cystationiny Escherichia coli przy rozdzielczości 1,5 A” . Dziennik EMBO . 17 (23): 6827–38. doi : 10.1093/emboj/17.23.6827 . PMC 1171030 . PMID 9843488 .
- Ravanel S, Gakière B, Job D, Douce R (kwiecień 1998). „Gama-syntaza cystationiny z Arabidopsis thaliana: oczyszczanie i charakterystyka biochemiczna rekombinowanego enzymu nadeksprymowanego w Escherichia coli” . Dziennik biochemiczny . 331 (Pt 2) (2): 639–48. doi : 10.1042/bj3310639 . PMC 1219399 . PMID 9531508 .