Efekt Gauche’a
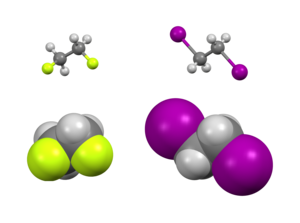
W badaniu izomerii konformacyjnej efekt Gauche jest nietypową sytuacją, w której konformacja gauche (grupy oddzielone kątem skręcenia około 60 °) jest bardziej stabilna niż konformacja anty (180 °).
Istnieją zarówno efekty steryczne , jak i elektroniczne , które wpływają na względną stabilność konformerów. Zwykle efekty steryczne przeważają przy umieszczaniu dużych podstawników daleko od siebie. Jednak nie dotyczy to niektórych podstawników, zazwyczaj tych, które są silnie elektroujemne . Zamiast tego istnieje elektroniczna preferencja dla tych grup, aby były niedbałe. Typowo badane przykłady obejmują 1,2-difluoroetan (H 2 FCCFH 2 ), glikol etylenowy i wicynalne struktury difluoroalkilowe.
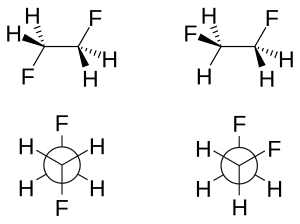 W 1,2-difluoroetanie, pokazanym w dwóch konformacjach (na górze) i odpowiadających im projekcjach Newmana (na dole), konformacja anty (po lewej) jest mniej stabilna niż konformacja gauche (po prawej).
W 1,2-difluoroetanie, pokazanym w dwóch konformacjach (na górze) i odpowiadających im projekcjach Newmana (na dole), konformacja anty (po lewej) jest mniej stabilna niż konformacja gauche (po prawej).
Istnieją dwa główne wyjaśnienia efektu nieostrości: hiperkoniugacja i wygięte wiązania . W modelu hiperkonjugacji za źródło stabilizacji izomeru gauche uważa się przekazanie gęstości elektronów z orbitalu wiążącego C – H σ na orbital antywiążący C – F σ * . Ze względu na większą elektroujemność fluoru orbital C–H σ jest lepszym donorem elektronów niż orbital C–F σ, podczas gdy orbital C–F σ* jest lepszym akceptorem elektronów niż orbital C–H σ * . Tylko konformacja typu gauche pozwala na dobre nakładanie się lepszego dawcy i lepszego akceptora.
Kluczem w wyjaśnieniu efektu giętkiego wiązania w difluoroetanie jest zwiększony charakter orbitalny p obu wiązań C – F z powodu dużej elektroujemności fluoru. W rezultacie gęstość elektronów narasta powyżej i poniżej, na lewo i na prawo od centralnego wiązania C-C. Wynikające z tego zmniejszone nakładanie się orbit można częściowo skompensować, gdy założy się konformację gauche, tworząc wygięte wiązanie. Spośród tych dwóch modeli, hiperkonjugacja jest ogólnie uważana za główną przyczynę efektu gauche w difluoroetanie.
Geometrię cząsteczkową obu rotamerów można uzyskać eksperymentalnie za pomocą spektroskopii w podczerwieni o wysokiej rozdzielczości , uzupełnionej pracą in silico . Zgodnie z opisanym powyżej modelem długość wiązań węgiel-węgiel jest większa dla antyrotameru (151,4 pm vs. 150). Odpychanie przestrzenne między atomami fluoru w rotamerze gauche powoduje zwiększenie kątów wiązań CCF (o 3,2°) i zwiększenie kątów dwuściennych FCCF (od domyślnych 60° do 71°).
Stwierdzono, że w pokrewnym związku 1,2-difluoro-1,2-difenyloetanie izomer treo (za pomocą dyfrakcji rentgenowskiej i stałych sprzęgania NMR ) ma konformację anty między dwiema grupami fenylowymi i dwiema grupami fluorowymi oraz konformacja gauche została znaleziona dla obu grup dla izomeru erytro . Według in silico ta konformacja jest bardziej stabilna o 0,21 kcal/mol (880 J/mol).
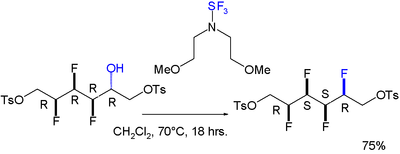
Zgłaszano również efekt rozmycia dla cząsteczki zawierającej układ all-syn składający się z czterech kolejnych podstawników fluorowych. Reakcja na zainstalowanie czwartego jest stereoselektywna :
Efekt gauche jest również widoczny w 1,2-dimetoksyetanie [ potrzebne źródło ] i niektórych wicynalnych związkach dinitroalkilowych.
Efekt cis alkenu jest analogicznym nietypowym stabilizowaniem niektórych alkenów.
Wpływy zewnętrzne
Efekt gauche jest bardzo wrażliwy na działanie rozpuszczalnika , ze względu na dużą różnicę w polaryzacji między dwoma konformerami. Na przykład 2,3-dinitro-2,3-dimetylobutan, który w stanie stałym występuje tylko w konformacji gauche, preferuje konformer gauche w benzenu w stosunku 79:21, ale w czterochlorku węgla preferuje konformer antykonformer w stosunku 58:42. Innym przypadkiem jest trans -1,2-difluorocykloheksan, który w bardziej polarnych rozpuszczalnikach bardziej preferuje konformer dwurównikowy niż konformer anty-dwuosiowy.