Enamina
Enamina jest nienasyconym związkiem powstałym w wyniku kondensacji aldehydu lub ketonu z drugorzędową aminą . Enaminy są wszechstronnymi półproduktami.
Słowo „enamina” pochodzi od przyrostka en- , używanego jako sufiks alkenu , i korzenia aminy . Można to porównać z enolem , który jest grupą funkcyjną zawierającą zarówno alken ( en- ), jak i alkohol (-ol ) . Enaminy są uważane za azotowe analogi enoli.
Jeśli jednym z podstawników azotu jest atom wodoru, H, jest to tautomeryczna postać iminy . To zwykle przestawi się na iminę; istnieje jednak kilka wyjątków (takich jak anilina ). Tautomeria enamina-imina może być uważana za analogiczną do tautomerii keto-enolu . W obu przypadkach atom wodoru zmienia swoje położenie między heteroatomem (tlenem lub azotem) a drugim atomem węgla.
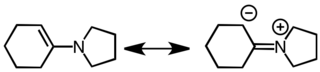
Enaminy są zarówno dobrymi nukleofilami, jak i dobrymi zasadami. Ich zachowanie jako nukleofilów opartych na węglu wyjaśniono w odniesieniu do następujących struktur rezonansowych.
Tworzenie
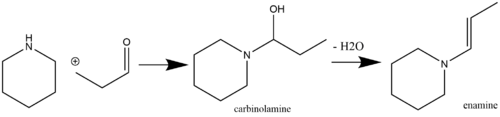
Enaminy są nietrwałymi, a zatem chemicznie użytecznymi ugrupowaniami, które można łatwo wytworzyć z dostępnych w handlu odczynników wyjściowych. Powszechną drogą wytwarzania enaminy jest katalizowana kwasem reakcja nukleofilowa związków ketonowych lub aldehydowych zawierających α-wodór z drugorzędowymi aminami. Kataliza kwasowa nie zawsze jest wymagana, jeśli pKa aH reagującej aminy jest wystarczająco wysokie (na przykład pirolidyna , która ma pKaH 11,26 ). Na2SO4 Jeśli jednak wymagana jest kataliza kwasowa zarówno pKaH reagującej aminy jest niskie, MgSO4 w etapie dodawania, jak i odwadniania (zwykłe środki odwadniające obejmują i ) . Aminy pierwszorzędowe zwykle nie są używane do syntezy enamin ze względu na preferencyjne tworzenie bardziej stabilnych termodynamicznie form imin. Samokondensacja metyloketonu jest reakcją uboczną, której można uniknąć poprzez dodanie TiCl4 do mieszaniny reakcyjnej (działa jako pochłaniacz wody ). Przykład aldehydu reagującego z drugorzędową aminą z wytworzeniem enaminy poprzez karbinoloaminę pokazano poniżej:
Reakcje
alkilowanie
Chociaż enaminy są bardziej nukleofilowe niż ich enolowe odpowiedniki, nadal mogą reagować selektywnie, co czyni je przydatnymi w reakcjach alkilowania. Nukleofil enaminy może atakować haloalkany , tworząc pośrednią sól alkilowaną iminu , która następnie hydrolizuje w celu regeneracji ketonu (materiału wyjściowego w syntezie enaminy). Ta reakcja została zapoczątkowana przez Gilberta Storka i jest czasami określana imieniem jej wynalazcy ( alkilowanie enaminy bociana ). Analogicznie, tę reakcję można zastosować jako skuteczny środek acylowania . W tej reakcji można stosować różne środki alkilujące i acylujące, w tym halogenki benzylowe i allilowe.
acylowanie
W reakcji bardzo podobnej do alkilowania enaminy, enaminy można acylować z wytworzeniem końcowego produktu dikarbonylowego . Materiał wyjściowy enaminy ulega addycji nukleofilowej do halogenków acylu , tworząc pośrednią sól iminiową, która może hydrolizować w obecności kwasu.
metaloenaminy
Mocne zasady, takie jak LiNR2 , można stosować do deprotonowania imin i tworzenia metaloenamin. Metaloenaminy mogą okazać się przydatne syntetycznie ze względu na ich nukleofilowość (są bardziej nukleofilowe niż enolany). W ten sposób są w stanie lepiej reagować ze słabszymi elektrofilami (na przykład można ich używać do otwierania epoksydów ). Co najważniejsze, reakcje te umożliwiły asymetryczne alkilowanie ketonów poprzez przekształcenie w chiralne pośrednie metaloenaminy.
halogenowanie
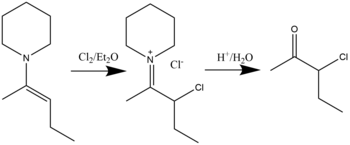
Związki β-halogenoimoniowe można syntetyzować w reakcji halogenowania enamin z halogenkami w rozpuszczalniku eteru dietylowego . Hydroliza spowoduje powstanie α-haloketonów. Wykazano, że możliwe jest chlorowanie, bromowanie, a nawet jodowanie. Ogólna reakcja jest pokazana poniżej:
Sprzężenie oksydacyjne
Enaminy można skutecznie sprzęgać krzyżowo z silanami enolowymi poprzez traktowanie azotanem cerowo-amonowym . Reakcje te zostały opisane przez grupę Narasaka w 1975 roku, zapewniając drogę do stabilnych enamin, a także jeden przypadek 1,4-diketonu (pochodzącego z odczynnika morfoliny ). Później wyniki te zostały wykorzystane przez MacMillan przy opracowaniu organokatalizatora , który wykorzystywał substraty Narasaka do enancjoselektywnej produkcji 1,4-dikarbonyli z dobrą wydajnością. Utleniająca dimeryzacja aldehydów w obecności amin przebiega poprzez tworzenie enaminy, po której następuje końcowe pirolu . Ta metoda symetrycznej syntezy pirolu została opracowana w 2010 roku przez grupę Jia jako cenna nowa ścieżka syntezy produktów naturalnych zawierających pirol.
Anulowanie
Chemia enamin została wdrożona w celu wytworzenia enancjoselektywnej wersji annulacji Robinsona w jednym naczyniu . Annulacja Robinsona, opublikowana przez Roberta Robinsona w 1935 r., Jest reakcją katalizowaną zasadą, która łączy keton i keton metylowo-winylowy (powszechnie w skrócie MVK), tworząc skondensowany układ pierścieni cykloheksenonu . Ta reakcja może być katalizowana przez prolinę , aby przejść przez chiralne półprodukty enaminowe, które pozwalają na dobrą stereoselektywność. Jest to ważne zwłaszcza w dziedzinie syntezy produktów naturalnych, np. syntezy ketonu Wielanda-Mieschera – istotnego budulca dla bardziej złożonych biologicznie aktywnych cząsteczek.
Reaktywność
Enaminy działają jak nukleofile, które wymagają mniejszej aktywacji kwasowo-zasadowej do reaktywności niż ich enolanowe odpowiedniki. Wykazano również, że oferują one większą selektywność przy mniejszej liczbie reakcji ubocznych. Istnieje gradient reaktywności między różnymi typami enamin, z większą reaktywnością oferowaną przez enaminy ketonowe niż ich odpowiedniki aldehydowe. Cykliczne enaminy ketonowe podążają za trendem reaktywności, w którym pięcioczłonowy pierścień jest najbardziej reaktywny ze względu na jego maksymalnie płaską konformację przy azocie, zgodnie z trendem 5>8>6>7 (pierścień siedmioczłonowy jest najmniej reaktywny). Tendencja ta została przypisana ilości znaku p na orbicie samotnej pary azotu - wyższy znak p odpowiada większej nukleofilowości, ponieważ orbital p pozwoliłby na darowiznę na orbital alkenu π. Analogicznie, jeśli samotna para N uczestniczy w oddziaływaniach stereoelektronicznych na ugrupowaniu aminowym, samotna para wyskoczy z płaszczyzny (utworzy piramidalizację ) i zagrozi donacji do sąsiedniego wiązania π CC.
Istnieje wiele sposobów modulowania reaktywności enaminy oprócz zmiany sterycznej / elektroniki w centrum azotu, w tym zmiana temperatury, rozpuszczalnika, ilości innych odczynników i rodzaju elektrofilu. Dostrojenie tych parametrów pozwala na preferencyjne tworzenie enamin E/Z, a także wpływa na tworzenie bardziej/mniej podstawionej enaminy z wyjściowego materiału ketonowego.
Zobacz też
- Reakcja Endersa SAMP/RAMP hydrazon-alkilowanie
- Reakcja Hajosa – Parrish – Eder – Sauer – Wiechert
- Dodatek Michał
- Synteza indolu Nenitzescu
- Organokataliza
- Anulowanie Robinsona
- Reakcja Thorpe'a
- Fluoksymesteron