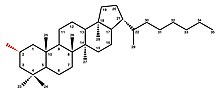
Hopanoidy

Hopanoidy to zróżnicowana podklasa triterpenoidów o takim samym szkielecie węglowodorowym jak złożony hopan . Ta grupa pentacyklicznych odnosi się zatem do prostych nadziejanów, hopanoli i hopanów, ale także do szeroko sfunkcjonalizowanych pochodnych, takich jak bakteriohopanopoliole (BHP) i hopanoidy kowalencyjnie przyłączone do lipidu A.
Pierwszy znany hopanoid, hydroksyhopanon, został wyizolowany przez dwóch chemików z The National Gallery w Londynie, którzy pracowali nad chemią gumy damarowej , naturalnej żywicy używanej jako werniks do obrazów. Chociaż często zakłada się, że hopanoidy są wytwarzane tylko w bakteriach, ich nazwa pochodzi od obfitości związków hopanoidowych w żywicy roślin z rodzaju Hopea . Z kolei ten rodzaj został nazwany na cześć Johna Hope'a , pierwszego Regiusa Keepera Królewskiego Ogrodu Botanicznego w Edynburgu .
Od czasu ich pierwszego odkrycia w roślinach okrytozalążkowych hopanoidy znajdowano w błonach plazmatycznych bakterii , porostów , mszaków , paproci , drzew tropikalnych i grzybów . Hopanoidy mają stabilne wielopierścieniowe struktury, które są dobrze zachowane w zbiornikach ropy naftowej, skałach i osadach, co pozwala na interpretację produktów diagenetycznych tych cząsteczek jako biomarkerów obecności określonych drobnoustrojów i potencjalnie warunków chemicznych lub fizycznych w czasie osadzanie . Hopanoidy nie zostały wykryte w archeonach .
Funkcja biologiczna
Około 10% zsekwencjonowanych genomów bakteryjnych ma przypuszczalny gen shc kodujący cyklazę skwalenowo-nadziejową i prawdopodobnie może wytwarzać hopanoidy, które, jak wykazano, odgrywają różne role w błonie komórkowej i mogą umożliwiać niektórym organizmom przystosowanie się w ekstremalnych środowiskach.
Ponieważ hopanoidy modyfikują właściwości błony komórkowej bakterii, często porównuje się je do steroli (np. cholesterolu ), które modulują płynność błony komórkowej i pełnią inne funkcje u eukariontów . Chociaż hopanoidy nie ratują niedoboru sterolu, uważa się, że zwiększają sztywność błony i zmniejszają przepuszczalność. Również gammaproteobakterie wykazano, że organizmy eukariotyczne, takie jak porosty i mszaki, wytwarzają zarówno sterole, jak i hopanoidy, co sugeruje, że te lipidy mogą pełnić inne odrębne funkcje. Warto zauważyć, że sposób upakowania hopanoidów w błonie plazmatycznej może się zmieniać w zależności od przyłączonych grup funkcyjnych. Bakteriohopanetetrol hopanoidowy przyjmuje orientację poprzeczną w dwuwarstwach lipidowych , ale diplopten lokalizuje się między wewnętrzną i zewnętrzną ulotką, prawdopodobnie pogrubiając błonę, aby zmniejszyć przepuszczalność.
Hopanoid diplopterol porządkuje błony poprzez interakcję z lipidem A , powszechnym lipidem błonowym u bakterii, w sposób podobny do interakcji cholesterolu i sfingolipidów w eukariotycznych błonach plazmatycznych. Wykazano, że diplopterol i cholesterol sprzyjają kondensacji i hamują tworzenie fazy żelowej w obu monowarstwach sfingomieliny i monowarstwy lipidu A modyfikowanego glikanem. Ponadto zarówno diplopterol, jak i cholesterol mogą ratować zależne od pH przejścia fazowe w monowarstwach lipidu A modyfikowanego glikanem. Rola hopanoidów w tolerancji kwasu za pośrednictwem błony jest dodatkowo poparta obserwacjami zahamowanego przez kwas wzrostu i nieprawidłowości morfologicznych błony komórkowej u bakterii z niedoborem hopanoidów ze zmutowanymi cyklazami skwalenowo-hopenowymi.
Hopanoidy są wytwarzane przez kilka bakterii wiążących azot . U promieniowca Frankia hopanoidy w błonach pęcherzyków wyspecjalizowanych w wiązaniu azotu prawdopodobnie ograniczają dostęp tlenu , czyniąc dwuwarstwę lipidową bardziej szczelną i zwartą. W Bradyrhizobium hopanoidy chemicznie związane z lipidem A zwiększają stabilność i sztywność błony, zwiększając tolerancję na stres i przeżycie wewnątrzkomórkowe roślin strączkowych Aeschynomene . W sinicach Nostoc punctiforme , duże ilości 2-metylohopanoidów lokalizują się w zewnętrznych błonach struktur przetrwania zwanych akinetami . W innym przykładzie tolerancji na stres, uważa się, że hopanoidy w strzępkach powietrznych (strukturach zawierających zarodniki) prokariotycznych bakterii glebowych Streptomyces minimalizują utratę wody przez błonę do powietrza.
Biosynteza
Synteza skwalenu
Ponieważ hopanoidy są terpenoidami C30 , biosynteza rozpoczyna się od pirofosforanu izopentenylu (IPP) i pirofosforanu dimetyloallilu (DMAP), które łączą się, tworząc izoprenoidy o dłuższym łańcuchu . Synteza tych mniejszych prekursorów przebiega szlakiem mewalonianu lub szlakiem metyloerytrytolo-4-fosforanu , w zależności od gatunku bakterii, chociaż ten ostatni jest bardziej powszechny. DMAP kondensuje z jedną cząsteczką IPP do pirofosforanu geranylu , który z kolei kondensuje z innym IPP, tworząc pirofosforan farnezylu (FPP) . Syntaza skwalenu , kodowana przez gen sqs , katalizuje następnie kondensację dwóch cząsteczek FPP do pirofosforanu preskwalenu (PSPP) przed utlenieniem NADPH w celu uwolnienia skwalenu . Jednak niektóre bakterie wytwarzające hopanoidy nie mają syntazy skwalenu i zamiast tego używają trzech enzymów HpnC, HpnD i HpnE, które są kodowane w operonie hpn wraz z wieloma innymi genami biosyntezy hopanoidów. W tym alternatywnym, ale pozornie bardziej rozpowszechnionym szlaku syntezy skwalenu, HpnD uwalnia pirofosforan ponieważ kondensuje dwie cząsteczki FPP do PSPP, który HpnC przekształca w hydroksyskwalen, zużywając cząsteczkę wody i uwalniając inny pirofosforan. Następnie hydroksyskwalen jest redukowany do skwalenu w reakcji odwodnienia, w której pośredniczy FAD .
Cyklizacja
Następnie cyklaza skwalenowo-hopenowa katalizuje skomplikowaną reakcję cyklizacji, angażując skwalen w energetycznie korzystną konformację wszystkich krzeseł przed utworzeniem 5 cykli, 6 wiązań kowalencyjnych i 9 centrów chiralnych w cząsteczce w jednym etapie. Enzym ten, kodowany przez gen shc ( zwany także hpnF u niektórych bakterii), ma podwójne ⍺-beczkowate fałdowanie charakterystyczne dla biosyntezy terpenoidów i jest obecny w komórce jako monotopowy homodimer , co oznacza, że pary cyklazy są osadzone, ale nie nie obejmują błony plazmatycznej. in vitro Enzym ten wykazuje rozwiązłą specyficzność substratową, cyklizując również 2,3-oksydoskwalen .
Reszty aromatyczne w miejscu aktywnym tworzą kilka niekorzystnych karbokationów na podłożu, które są gaszone przez szybką policyklizację. W ostatnim podetapie reakcji cyklizacji, po tym, jak elektrony zawierające końcowe wiązanie alkenowe na skwalenie zaatakują karbokation nadziejanylu w celu zamknięcia pierścienia E, karbokation C22 może zostać wygaszony przez mechanizmy prowadzące do różnych produktów hopanoidowych. Atak nukleofilowy wody da diplopterol, podczas gdy deprotonowanie na sąsiednim węglu utworzy jeden z kilku izomerów nadziei, często diploptenu.
Funkcjonalizacja
Po cyklizacji hopanoidy są często modyfikowane przez enzymy biosyntezy hopanoidów kodowane przez geny w tym samym operonie co shc , hpn . Na przykład radykalne białko SAM HpnH dodaje grupę adenozynową do diploptenu, tworząc wydłużony adenozylohopan C35 hopanoidowy , który może być dalej funkcjonalizowany przez inne hpn produkty genów. HpnG katalizuje usuwanie adeniny z adenozylohopanu w celu wytworzenia rybozylohopanu, który reaguje tworząc bakteriohopanetetrol (BHT) w reakcji, w której pośredniczy nieznany enzym. Dodatkowe modyfikacje mogą wystąpić, gdy HpnO aminuje końcową grupę hydroksylową na BHT, wytwarzając aminobakteriohopanetriol lub gdy glikozylotransferaza HpnI przekształca BHT w N-acetyloglukozaminylo-BHT. Kolejno, białko HpnK związane z biosyntezą hopanoidów pośredniczy w deacetylacji do glukozaminylo-BHT, z którego rodnikowe białko SAM HpnJ generuje eter cyklitolu.
Co ważne, hopanoidy C30 i C35 mogą być metylowane w pozycjach C2 i C3 odpowiednio przez rodnikowe metylotransferazy SAM , odpowiednio, HpnP i HpnR. Te dwie metylacje są szczególnie geostabilne w porównaniu z modyfikacjami łańcuchów bocznych i od dziesięcioleci bawią geobiologów.
W szlaku biosyntezy występującym wyłącznie u niektórych bakterii enzym syntaza tetrahymanolowa katalizuje konwersję diploptenu hopanoidowego do pentacyklicznego triterpenoidowego tetrahymanolu . U eukariotów, takich jak Tetrahymena , tetrahymanol jest zamiast tego syntetyzowany bezpośrednio ze skwalenu przez cyklazę bez homologii z bakteryjną syntazą tetrahymanolu.
W paleobiologii
Szacuje się, że hopanoidy są najobficiej występującymi produktami naturalnymi na Ziemi, pozostając we frakcji organicznej wszystkich osadów, niezależnie od wieku, pochodzenia czy natury. Całkowitą ilość na Ziemi oszacowano na 10 x 10 18 gramów (10 12 ton) w 1992 r. Biomolekuły, takie jak DNA i białka, ulegają degradacji podczas diagenezy , ale wielopierścieniowe lipidy utrzymują się w środowisku w geologicznych skalach czasowych dzięki ich połączonym, stabilnym strukturom. Chociaż hopanoidy i sterole są redukowane do hopanów i steranów podczas osadzania te produkty diagenetyczne mogą nadal być użytecznymi biomarkerami lub skamielinami molekularnymi do badania koewolucji wczesnego życia i Ziemi.
Obecnie najstarszymi wykrytymi niekwestionowanymi skamielinami triterpenoidowymi są mezoproterozoiczne okenany , sterany i metylohopany z basenu Australii liczącego 1,64 Ga (miliarda lat). Jednak analizy zegara molekularnego szacują, że najwcześniejsze sterole zostały prawdopodobnie wyprodukowane około 2,3 Ga temu, mniej więcej w tym samym czasie co Wielkie Utlenianie , a synteza hopanoidów pojawiła się jeszcze wcześniej.
Z kilku powodów przypuszcza się, że hopanoidy i cyklazy skwalenowo-nadziejowe są starsze niż sterole i cyklazy oksydoskwalenowe. Po pierwsze, diplopterol jest syntetyzowany, gdy woda gasi karbokation C22 utworzony podczas policyklizacji. Wskazuje to, że hopanoidy mogą być wytwarzane bez tlenu cząsteczkowego i mogą służyć jako substytut sterolu, zanim w atmosferze zgromadzi się tlen, który reaguje ze skwalenem w reakcji katalizowanej przez monooksygenazę skwalenu podczas biosyntezy steroli. Ponadto skwalen wiąże się z cyklazami skwalenu-hopenu w niskoenergetycznej konformacji obejmującej wszystkie krzesła, podczas gdy oksydoskwalen jest cyklizowany w bardziej napiętej konformacji krzesło-łódka-krzesło-łódź. Cyklazy skwalenowo-nadziejowe wykazują również większą rozwiązłość substratów, ponieważ cyklizują oksydoskwalen in vitro , co powoduje, że niektórzy naukowcy postawili hipotezę, że są ewolucyjnymi poprzednikami cyklaz oksydoskwalenowych. Inni naukowcy sugerowali, że cyklazy skwalenowo-nadziejowe i oksydoskwalenowe odbiegały od wspólnego przodka, domniemanej cyklazy bakteryjnej, która stworzyłaby tricykliczny malabarykanoid lub tetracykliczny produkt dammaranoidowy .
2-metylohopanoidy
Jako biomarker dla sinic
Wniosek
2-metylohopany, często określane ilościowo jako wskaźnik 2-α-metylohopanu, zostały po raz pierwszy zaproponowane jako biomarker fotosyntezy tlenowej przez Rogera Summonsa i współpracowników po odkryciu prekursorowych lipidów, 2-metylohopanoli, w kulturach sinic i matach. Późniejsze odkrycie 2-α-metylohopanów rzekomo z fotosyntetycznych cyjanobakterii w starych łupkach 2,7 Ga z kratonu Pilbara w Zachodniej Australii sugerowało 400 mA (milion lat) luka między ewolucją metabolizmu tlenowego a Wielkim Zdarzeniem Utleniania. Jednak odkrycia te zostały później odrzucone ze względu na potencjalne zanieczyszczenie współczesnymi węglowodorami.
Przypuszczalna obecność cyjanobakterii na podstawie obfitych 2-metylohopanów została wykorzystana do wyjaśnienia osadzania się czarnych łupków podczas zdarzeń beztlenowych w oceanach aptyjskich i cenomańsko-turońskich (OAE) oraz związanych z nimi sygnatur izotopowych 15 N wskazujących na wiązanie N 2 . W przeciwieństwie do tego, wartości wskaźnika 2-α-metylohopanu są stosunkowo niskie w podobnych franu i famenu , odpowiadających zdarzeniu (zdarzeniom) z Kellwasser , chociaż wyższe poziomy odnotowano w późniejszych sekcjach dolnego famenu.
Spór
Status 2-metylohopanoidów jako biomarkera cyjanobakterii został zakwestionowany przez szereg odkryć mikrobiologicznych. Wykazano, że Geobacter sulfurreducens syntetyzuje różne hopanole, chociaż nie 2-metylo-hopanole, gdy są hodowane w ściśle beztlenowych warunkach. Ponadto stwierdzono , że beztlenowy fototrof Rhodopseudomonas palustris wytwarza 2-metylo-BHP tylko w warunkach beztlenowych. To ostatnie odkrycie doprowadziło również do identyfikacji genu kodującego kluczową metylotransferazę HpnP. hpnP został następnie zidentyfikowany w acidobacterium i liczne alphaproteobacteria i analiza filogenetyczna genu wykazała, że pochodzi on z alfaproteobakterii i został przejęty przez cyjanobakterie i acidobacteriota poprzez poziomy transfer genów .
Wśród cyjanobakterii produkcja hopanoidów jest generalnie ograniczona do cyjanobakterii lądowych. Wśród cyjanobakterii morskich eksperymenty hodowlane przeprowadzone przez Helen Talbot i współpracowników wykazały, że tylko dwa gatunki morskie – Trichodesmium i Crocosphaera – wytwarzają bakteriohopanopoliole. Późniejsze oparte na genach poszukiwania hpnP w dostępnych genomach cyjanobakterii i zmontowanych genomach metagenomu (MAG) przyniosły podobne wnioski, identyfikując gen u ~ 30% gatunków lądowych i słodkowodnych oraz tylko jeden z 739 morskich genomów cyjanobakterii i MAG. Dodatkowo, Nostoc punctiforme wytwarza największą ilość 2-metylohopanoidów, gdy różnicuje się w akinety . Te struktury komórkowe odporne na zimno i wysychanie są uśpione, a zatem nie są aktywne fotosyntetycznie, co dodatkowo kwestionuje związek między 2-metylohopanami a fotosyntezą tlenową.
Inne interpretacje
Badania wykazujące, że bakterie utleniające azotyny (NOB) Nitrobacter vulgaris zwiększają produkcję 2-metylohopanoidów 33-krotnie, gdy są suplementowane kobalaminą , przyczyniły się do niecyjanobakteryjnego wyjaśnienia obserwowanej obfitości 2-metylohopanów związanych z kredowymi OAE. Felix Elling i współpracownicy proponują, że odwrócenie cyrkulacji wyniosło na powierzchnię bogate w amoniak i kobalt głębokie wody, sprzyjając odpowiednio tlenowemu utlenianiu azotynów i syntezie kobalaminy. Model ten odnosi się również do widocznego braku 2-metylohopanów związanego z sapropelem śródziemnomorskim wydarzeń i we współczesnych osadach Morza Czarnego . Ponieważ oba środowiska charakteryzują się znacznie mniejszym upwellingiem, NOB wytwarzające 2-metylohopanoidy, takie jak N. vulgaris , są konkurowane przez NOB o wyższym powinowactwie do azotynów i bakterie anammox .
Badanie środowiskowe przeprowadzone przez Jessicę Ricci i współautorów przy użyciu metagenomów i bibliotek klonów wykazało istotną korelację między zbiorowiskami drobnoustrojów związanych z roślinami a obecnością hpnP , na podstawie której proponują, że 2-metylohopanoidy są biomarkerem dla osiadłych społeczności drobnoustrojów o wysokiej osmolarności i niskiej zawartości tlenu i stały azot.
3-metylohopanoidy
3-metylohopanoidy były historycznie kojarzone z metanotrofią tlenową na podstawie eksperymentów kulturowych i współwystępowania z metanotrofami tlenowymi w środowisku. W związku z tym obecność 3-metylohopanów wraz z 13 C jest uważana za markery starożytnej metanotrofii tlenowej. Jednak od dziesięcioleci wiadomo, że bakterie kwasu octowego wytwarzają również 2-metylohopanoidy. Dodatkowo, po zidentyfikowaniu hpnR , genu odpowiedzialnego za metylację hopanoidów w pozycji C3 , Paula Welander i Roger Summons zidentyfikował domniemane homologi hpnR u przedstawicieli alfa- , beta- i gammaproteobacteria , promieniowców , nitrospirota , typu kandydującego NC10 i acidobacterium , a także w trzech metagenomach. W związku z tym Welander i Summons doszli do wniosku, że same 3-metylohopanoidy nie mogą stanowić dowodu na metanotrofię tlenową.
Aplikacje
Przemysł
Elegancki mechanizm aktywności protonazy cyklazy skwalenowo-nadziejowej został doceniony i zaadaptowany przez inżynierów chemików z Uniwersytetu w Stuttgarcie w Niemczech. Inżynieria miejsca aktywnego spowodowała utratę zdolności enzymu do tworzenia hopanoidów, ale umożliwiła kwasową Brønsteda do stereoselektywnej cyklizacji monoterpenoidów geraniolu , epoksygeraniolu i cytronelalu .
Rolnictwo
Zastosowanie hopanoidów i środków wiążących azot wytwarzających hopanoidy do gleby zostało zaproponowane i opatentowane jako technika bionawozów, która zwiększa odporność środowiskową symbiontów drobnoustrojów związanych z roślinami, w tym bakterii wiążących azot, które są niezbędne do przekształcania azotu atmosferycznego w rozpuszczalne formy dostępne dla upraw .
Medycyna
Podczas późniejszych badań interakcji między diplopterolem a lipidem A w Methylobacterium extorquens stwierdzono, że transport wielu leków jest procesem zależnym od hopanoidów. Mutanty cyklazy skwalenowo-nadziejowej pochodzące z typu dzikiego zdolne do wypływu wielu leków, mechanizmu oporności na leki, w którym pośredniczą integralne białka transportowe, utraciły zdolność do wykonywania zarówno transportu wielolekowego, jak i syntezy hopanoidów. Naukowcy wskazują, że może to wynikać z bezpośredniej regulacji białek transportowych przez hopanoidy lub pośrednio poprzez zmianę uporządkowania błon w sposób zakłócający system transportowy.