Hydrogenaza NiFe
Hydrogenaza [NiFe] jest rodzajem hydrogenazy , która jest enzymem oksydacyjnym , który odwracalnie przekształca wodór cząsteczkowy u prokariotów , w tym bakterii i archeonów . Miejsce katalityczne enzymu zapewnia prostym mikroorganizmom metabolizującym wodór redoks , dzięki któremu mogą magazynować i wykorzystywać energię poprzez reakcję pokazaną na rycinie 1. Jest to szczególnie istotne dla bakterii beztlenowych , redukujących siarczany z rodzaju Desulfovibrio , jak również patogennych organizmy Escherichia coli i Helicobacter pylori . Mechanizmy, dojrzewanie i funkcja hydrogenaz [NiFe] są aktywnie badane pod kątem zastosowań w gospodarce wodorowej i jako potencjalne cele antybiotyków.
Struktura
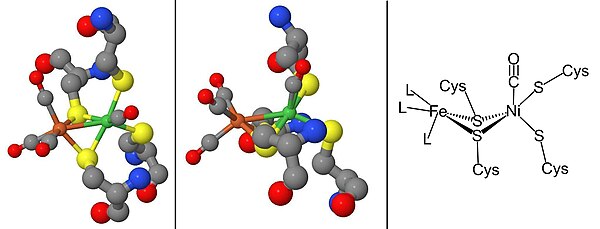
Strukturę hydrogenazy [NiFe] uzyskano z badań krystalografii rentgenowskiej pięciu różnych bakterii redukujących siarczany: D. vulgaris Miyazaki F, D. gigas , D. frutosovorans , D. desulfuricans i Desulfomicrobium baculatum . Hydrogenaza [NiFe] wyizolowana z D. vulgaris Miyazaki F jest pokazana na rycinie 2. Większa podjednostka jest zaznaczona na niebiesko, ma masę cząsteczkową 62,5 kDa i zawiera miejsce aktywne Ni-Fe . Mniejsza podjednostka jest w kolorze magenta, ma masę cząsteczkową 28,8 kDa i zawiera klastry Fe-S (patrz klaster żelazo-siarka ).
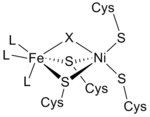
Na podstawie widm w podczerwieni i badań krystalografii rentgenowskiej stwierdzono, że miejscem aktywnym hydrogenazy [NiFe] jest (S-Cys) 4 Ni(μ-X)Fe(CO)(CN) 2 , w którym ogólny ligand X jest albo tlenek , siarka , wodoronadtlenek lub wodorotlenek występujący tylko w stanie utlenionym (Rysunek 3). Podczas gdy atom niklu bierze udział w reakcjach redoks, atom żelaza stale znajduje się na stopniu utlenienia Fe(II). Dokładna geometria trzech ligandów niebiałkowych (oznaczone jako L) koordynacja z jonem metalu Fe nie jest znana; jednakże zidentyfikowano je jako jedną tlenku węgla (C≡O) i dwie cząsteczki cyjanku ( - C≡N).
Klastry Fe-S
Prawie wszystkie hydrogenazy zawierają co najmniej jeden klaster żelazowo-siarkowy (klaster Fe-S). Jak wcześniej wspomniano, te skupiska Fe-S łączą aktywne miejsce niklu enzymu z powierzchnią białka, ponieważ służą jako łańcuch transportu elektronów z miejsca redoks Ni-Fe do akceptora elektronów cytochromu c 3 (patrz rodzina cytochromów c ). Elektrony te powstają w wyniku heterolitycznego rozszczepienia cząsteczki wodoru w miejscu aktywnym Ni-Fe. Struktury krystaliczne hydrogenazy wykazują Fe 3 S 4 w środku łańcucha i Fe 4 S 4 na powierzchni cząsteczki. Odległość między wewnętrznym skupiskiem Fe 4 S 4 a miejscem aktywnym wynosi około 12 Å (ryc. 4).
Hydrogenazy [NiFe] i [NiFeSe] mają niezwykle podobne struktury, co prowadzi do sugestii, że jedna siarka w klastrze Fe-S została zastąpiona atomem selenu, ale te hydrogenazy różnią się reaktywnością katalityczną i wrażliwością na inhibitory enzymów .

Jon metalu Mg i szlaki protonowe
Hydrogenaza [NiFe] ma kation Mg 2+ związany w regionie C-końca większej podjednostki. Ten kation jest związany z trzema cząsteczkami wody i trzema aminokwasami i stabilizuje ten wolny od rozpuszczalników region. W odległości około 13 Å od ugrupowania [NiFe] kation ten łączy miejsce aktywne z siecią wiązań wodorowych i służy jako szlak przenoszenia protonu (H + ).
Kanał dostępu do gazu
Badania, w których ksenon był związany z hydrogenazą, sugerują istnienie hydrofobowego kanału gazowego, przez który gazy H2 , CO i O2 mogą dotrzeć do głęboko zakopanego miejsca aktywnego w enzymie. Struktura krystaliczna ujawniła kilka małych kanałów na powierzchni, które połączyły się w jeden większy kanał, który dotarł do miejsca aktywnego [Ni-Fe].
Ponieważ wiadomo, że hydrogenazy są wrażliwe na tlen , dyfuzja gazu do miejsca aktywnego zależy od wielkości i środowiska kanału dostępu do gazu, reakcji tlenu cząsteczkowego (O 2 ) w miejscu aktywnym oraz odzyskiwania miejsce aktywne po utlenieniu.
Mechanizm
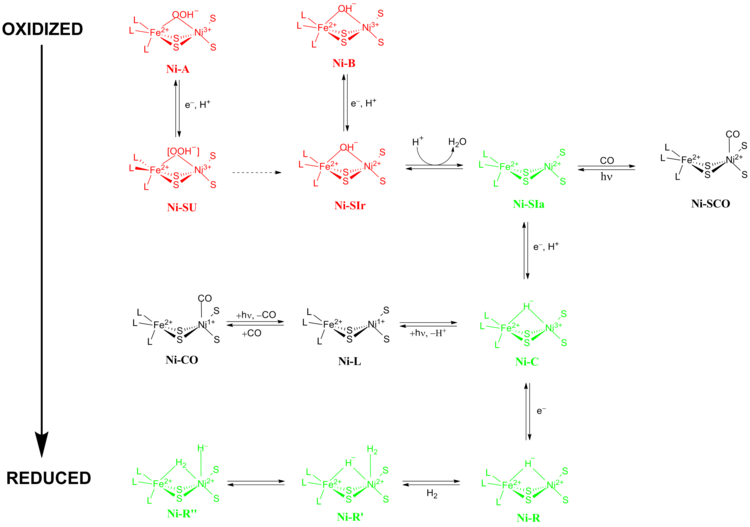
Dokładny mechanizm reakcji wodoraz [NiFe] był przedmiotem wielkiej debaty. W 2009 roku Higuchi i współpracownicy zaproponowali mechanizm oparty na krystalografii rentgenowskiej i danych spektroskopowych Desulfovibrio vulgaris Miyazaki F. Podczas procesu katalitycznego jon metalu Fe w miejscu aktywnym nie zmienia swojego stopnia utlenienia , podczas gdy jon metalu Ni bierze udział w chemii redoks. Istnieją dwie główne grupy stanów redoks, przez które przechodzą hydrogenazy [NiFe] podczas katalizy: 1) nieaktywne stany redoks i 2) aktywne stany redoks (ryc. 5).
Nieaktywne stany redoks
Ni-A (stan „niegotowy”) i Ni-B (stan „gotowy”) są najbardziej utlenionymi formami metalicznego centrum [NiFe] i są aktywowane poprzez jednoelektronową redukcję z przeniesieniem protonu. Szybkość redukcyjnej aktywacji Ni-A do Ni-SU może zająć godziny, podczas gdy szybkość redukcyjnej aktywacji Ni-B do Ni-SIr następuje w kilka sekund. Przyczyna tej rozbieżności w kinetyce aktywacji między Ni-A i Ni-B zaproponowano jako wynik różnicy w ligandach mostkowych między dwoma różnymi stanami redoks. W Ni-SIr cząsteczka wody została uwolniona, tworząc stan Ni-SIa , pierwszy katalityczny stan aktywny redoks wodoraz [NiFe].
Aktywne stany redoks
Trzy najważniejsze katalityczne stany aktywne redoks wodoraz [NiFe] to Ni-SIa , Ni-C i Ni-R (które mają trzy różne odmiany:). Światłoczuły Ni-C można uzyskać poprzez redukcję jednego elektronu Ni-SIa . Badania spektroskopowe elektronowego rezonansu paramagnetycznego stanu Ni-C , który zawierał Ni 3+ o S=1/2 (patrz Spin-1/2 ) i wodorek łączący dwa metale Ni i Fe, wykazały, że heterolityczne rozszczepienie H2 _ zachodzi w miejscu aktywnym hydrogenazy [NiFe].
Stany zahamowane CO
Ni-SIa może być hamowany przez CO, który wiąże się bezpośrednio z jonem metalu Ni w wygiętej konformacji, tworząc Ni-SCO (patrz poniżej). Ponieważ Ni-C jest wrażliwy na światło, po oświetleniu w temperaturze 100K uzyskuje się stan redoks Ni-L . W obecności CO Ni-L tworzy stan Ni-CO .
Dojrzewanie i układ genetyczny
Dojrzewanie wodoraz [NiFe] wymaga zestawu białek pomocniczych, które syntetyzują miejsce aktywne NiFe, ryc. 2, i modyfikują enzym prekursorowy, aby miał prawidłową strukturę i lokalizację. Dojrzewanie centrum aktywnego jest szczególnie interesujące ze względu na syntezę ligandów metalicznych cyjanku (CN) i tlenku węgla (CO), które zwykle są toksyczne dla żywych organizmów. Ten etap jest zakończony przez białka HypC, HypD, HypE i HypF. Po syntezie centrum żelaza wprowadzany jest nikiel za pomocą metalochaperonów HypA, HypB i SlyD. Gdy centrum katalityczne zostanie ukończone, prekursor hydrogenazy ulega rozszczepieniu na C-końcu, co powoduje przegrupowanie jego struktury i połączenie z małą podjednostką. Na koniec gotowy enzym jest transportowany do właściwej pozycji w komórce. Promotor hydrogenazy, PSH , można badać konstruując fuzję promotor PSH- gfp , stosując gen reporterowy białka zielonej fluorescencji ( gfp) .
Aplikacja
Ponieważ hydrogenaza [NiFe] należy do rodziny hydrogenaz , enzymy te mogą katalizować zarówno zużycie, jak i produkcję wodoru. Badając hydrogenazę [NiFe], naukowcy mogą zoptymalizować warunki, w których białko będzie wytwarzać tylko wodór. można zsyntetyzować mały enzym naśladujący hydrogenazę [NiFe], aby działał jako generator gazowego wodoru. Rozpuszczalna wodoraza [NiFe] z Ralstonia eutropha H16 jest obiecującym kandydatem na enzym do zastosowania w biopaliwach na bazie H2, ponieważ faworyzuje H2 utlenianie i jest stosunkowo odporny na tlen. Można go wytwarzać na heterotroficznych pożywkach wzrostowych i oczyszczać za pomocą matryc do chromatografii anionowymiennej i wykluczania .