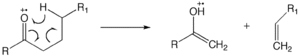Interpretacja widm masowych
Interpretacja widm masowych to metoda stosowana do identyfikacji wzoru chemicznego, charakterystycznych wzorów fragmentów i ewentualnych jonów fragmentów z widm masowych. Widma masowe to wykres względnej obfitości w funkcji stosunku masy do ładunku. Jest powszechnie stosowany do identyfikacji związków organicznych za pomocą spektrometrii mas z jonizacją elektronową . Chemicy organicy uzyskują widma masowe związków chemicznych w ramach wyjaśniania struktury, a analiza jest częścią wielu programów nauczania chemii organicznej .
Generowanie widm masowych

Jonizacja elektronowa (EI) to rodzaj źródła jonów w spektrometrze mas , w którym wiązka elektronów oddziałuje z cząsteczką fazy gazowej M, tworząc jon zgodnie z
z jonem molekularnym . Indeks górny „+” oznacza ładunek jonu, a indeks górny „•” oznacza niesparowany elektron rodnika jonowego . Energia wiązki elektronów wynosi zwykle 70 elektronowoltów , a proces jonizacji zwykle powoduje rozległą fragmentację wiązań chemicznych cząsteczki.
Ze względu na wysokie podciśnienie w komorze jonizacyjnej średnie drogi swobodne cząsteczek wahają się od 10 cm do 1 km i wówczas fragmentacja jest procesem jednocząsteczkowym. Po zainicjowaniu fragmentacji elektron jest najpierw wzbudzany z miejsca o najniższej energii jonizacji. Ponieważ kolejność energii elektronów jest następująca: elektrony niewiążące> elektrony wiązania pi> elektrony wiązania sigma, kolejność preferencji jonizacji jest następująca: elektrony niezwiązane> elektrony wiązania pi> elektrony wiązania sigma.
Pik w widmie masowym o największej intensywności nazywany jest pikiem podstawowym. Pik odpowiadający jonowi cząsteczkowemu jest często, ale nie zawsze, pikiem podstawowym. Identyfikacja jonu molekularnego może być trudna. Badając związki organiczne, względna intensywność piku jonu molekularnego zmniejsza się wraz z rozgałęzieniem i wzrostem masy w szeregu homologicznym. w widmie toluenu pik jonu cząsteczkowego znajduje się przy 92 m/z, co odpowiada jego masie cząsteczkowej . Piki jonów cząsteczkowych są również często poprzedzone pikiem M-1 lub M-2 wynikającym odpowiednio z utraty rodnika wodorowego lub diwodoru. Tutaj M odnosi się do masy cząsteczkowej związku. W widmie toluenu następuje utrata rodnika wodorowego (para proton-elektron), tworząc pik M-1 (91).
Piki o masie mniejszej niż jon cząsteczkowy są wynikiem fragmentacji cząsteczki. Istnieje wiele ścieżek reakcji fragmentacji, ale w widmie masowym pojawią się tylko nowo utworzone kationy, a nie fragmenty rodnikowe lub fragmenty obojętne. Piki metastabilne to szerokie piki o niskiej intensywności przy niecałkowitych wartościach masowych. Piki te wynikają z obecności jonów o czasie życia krótszym niż czas potrzebny do pokonania odległości między komorą jonizacyjną a detektorem.
Wyznaczanie wzoru cząsteczkowego
Reguła azotu
Reguła azotu mówi , że cząsteczki organiczne zawierające wodór , węgiel , azot , tlen , krzem , fosfor , siarkę lub halogeny mają nieparzystą masę nominalną , jeśli mają nieparzystą liczbę atomów azotu lub parzystą masę, jeśli mają parzystą liczbę obecne są atomy azotu. Reguła azotu jest prawdziwa dla struktur, w których wszystkie atomy w cząsteczce mają liczbę wiązań kowalencyjnych równą ich standardowej wartościowości, licząc każde wiązanie sigma i wiązanie pi jako oddzielne wiązanie kowalencyjne.
Rządzą pierścienie
Z zasady stopnia nienasycenia cząsteczki zawierające tylko węgiel, wodór, halogeny, azot i tlen są zgodne ze wzorem
gdzie C to liczba atomów węgla, H to liczba atomów wodoru, X to liczba halogenów, a N to liczba atomów azotu.
Nawet rządy elektronów
Reguła parzystych elektronów mówi, że jony o parzystej liczbie elektronów (kationy, ale nie jony rodnikowe) mają tendencję do tworzenia jonów fragmentów parzystych elektronów, a jony nieparzystoelektronowe (jony rodnikowe) tworzą jony nieparzystoelektronowe lub jony parzystoelektronowe. Gatunki parzystych elektronów mają tendencję do fragmentacji na inny kation parzystych elektronów i cząsteczkę obojętną, a nie na dwa rodzaje nieparzystych elektronów.
OE +• →EE + + R • , OE +• →OE +• + N
Reguły Stevensona
Im bardziej stabilny kation produktu, tym bardziej obfity jest odpowiedni proces rozkładu. Do przewidywania procesu fragmentacji można wykorzystać kilka teorii, takich jak reguła oktetu elektronów, stabilizacja rezonansu i hiperkoniugacja i tak dalej.
Zasada 13
Reguła 13 to prosta procedura tworzenia tabelarycznych możliwych wzorów chemicznych dla danej masy cząsteczkowej. Pierwszym krokiem w zastosowaniu reguły jest założenie, że w cząsteczce występuje tylko węgiel i wodór oraz że cząsteczka zawiera pewną liczbę „jednostek” CH, z których każda ma nominalną masę równą 13. Jeśli masa cząsteczkowa cząsteczki w pytanie to M , liczba możliwych jednostek CH to n i
gdzie r jest resztą. Podstawowy wzór cząsteczki to
a stopień nienasycenia wynosi
Ujemna wartość u wskazuje na obecność heteroatomów w cząsteczce, a pół-całkowita wartość u wskazuje na obecność nieparzystej liczby atomów azotu. Po dodaniu heteroatomów wzór cząsteczkowy jest dostosowywany przez równoważną masę węgla i wodoru. Na przykład dodanie N wymaga usunięcia CH2, a dodanie O wymaga usunięcia CH4 .
Efekty izotopowe
Piki izotopowe w widmie mogą pomóc w wyjaśnieniu struktury. Związki zawierające halogeny (zwłaszcza chlor i brom ) mogą dawać bardzo wyraźne piki izotopowe. Widmo masowe bromku metylu ma dwa wyraźne piki o równej intensywności przy m/z 94 (M) i 96 (M+2), a następnie dwa kolejne przy 79 i 81 należące do fragmentu bromu.
Nawet jeśli związki zawierają tylko pierwiastki o mniej intensywnych pikach izotopowych ( węgiel lub tlen ), rozkład tych pików można wykorzystać do przypisania widma właściwemu związkowi. Na przykład dwa związki o identycznej masie 150 Da, C 8 H 12 N 3 + i C 9 H 10 O 2 + , będą miały dwie różne intensywności M+2, co pozwala na ich rozróżnienie.
Podział
Wzór fragmentacji widm oprócz określenia masy molowej nieznanego związku jest również odpowiedni do uzyskania informacji strukturalnych, zwłaszcza w połączeniu z obliczeniem stopnia nienasycenia na podstawie wzoru cząsteczkowego (jeśli jest dostępny). Częściami neutralnymi często traconymi są tlenek węgla , etylen , woda , amoniak i siarkowodór . Istnieje kilka procesów fragmentacji, jak następuje.
α - rozszczepienie
Fragmentacja powstaje w wyniku procesów homolizy . To rozszczepienie wynika z tendencji niesparowanego elektronu z miejsca rodnikowego do łączenia się w parę z elektronem z innego wiązania do atomu sąsiadującego z miejscem ładunkowym, jak pokazano poniżej. Ta reakcja jest zdefiniowana jako rozszczepienie homolityczne, ponieważ przenoszony jest tylko jeden elektron. Siłą napędową takiej reakcji są elektronodonorowe zdolności miejsc rodnikowych: N > S, O, π > Cl, Br > H. Przykładem jest rozszczepianie wiązań węgiel- węgiel obok heteroatomu . Na tym rysunku ruchy pojedynczych elektronów są oznaczone literą a strzała jednogłowa .
Rozszczepienie wiązania sigma
Jonizacja alkanów osłabia wiązanie CC, ostatecznie prowadząc do rozkładu. Gdy wiązanie pęka, generowane są naładowane, parzyste elektrony (R+) i neutralne rodniki (R•). Wysoce podstawione karbokationy są bardziej stabilne niż niepodstawione. Poniżej przedstawiono przykład.
Rozszczepienie indukcyjne
Ta reakcja wynika z indukcyjnego efektu miejsc rodnikowych, jak pokazano poniżej. Ta reakcja jest zdefiniowana jako rozszczepienie heterolityczne, ponieważ przenoszona jest para elektronów. Siłą napędową takiej reakcji są elektroujemności miejsc rodnikowych: halogeny > O, S >> N, C. Reakcja ta jest mniej uprzywilejowana niż reakcje miejsc rodnikowych.
przegrupowanie McLafferty'ego
Przegrupowanie McLafferty'ego może wystąpić w cząsteczce zawierającej grupę ketonową i obejmuje rozszczepienie β, z wzmocnieniem atomu wodoru γ. Tworzenie jonowo-neutralnego kompleksu obejmuje homolizę wiązań lub heterolizę wiązań, w której fragmenty nie mają wystarczającej energii kinetycznej do rozdzielenia, a zamiast tego reagują ze sobą jak reakcja jon-cząsteczka.
Przegrupowanie wodoru do nasyconego heteroatomu
Przesunięcie wodoru „1,5” powoduje przeniesienie jednego γ-wodoru do miejsca rodnikowego na nasyconym heteroatomie. Te same wymagania dotyczące przegrupowania McLafferty'ego dotyczą przegrupowania wodoru do nasyconego heteroatomu. Takie przegrupowanie inicjuje reakcję w miejscu ładunku, w wyniku której powstaje nieparzysty jon elektronowy i mała obojętna cząsteczka (woda, kwas itp.). W przypadku alkoholi to rozszczepienie heterolityczne uwalnia cząsteczkę wody. Ponieważ reakcje miejsc ładunku są dominujące w mniej objętościowych alkoholach, ta reakcja jest preferowana dla alkoholi jako pierwszorzędowe > drugorzędowe > trzeciorzędowe.
Podwójne przegrupowanie wodoru
Przesunięcie wodoru „1,5” powoduje przeniesienie dwóch γ-wodorów do dwóch rodników na dwóch różnych nienasyconych atomach. Te same wymagania dotyczące przegrupowania McLafferty'ego dotyczą przegrupowania podwójnego wodoru. Reakcję tę obserwuje się dla trzech nienasyconych grup funkcyjnych, a mianowicie tioestrów, estrów i amidów.
Przegrupowanie orto
Przesunięcie wodoru „1,5” powoduje przeniesienie dwóch γ-wodorów do dwóch rodników na dwóch różnych nienasyconych atomach. Te same wymagania dla przesunięcia wodoru „1,5” występują między odpowiednimi podstawnikami w pozycjach orto pierścieni aromatycznych. Te same wymagania dotyczące przegrupowania McLafferty'ego mają zastosowanie do przegrupowania orto, z wyjątkiem silnego wiązania podwójnego α, β węgiel-węgiel. Takie przegrupowanie inicjuje reakcję w miejscu ładunku, w wyniku której powstaje nieparzysty jon elektronowy i mała obojętna cząsteczka (woda lub HCl i tak dalej). Reakcję tę można wykorzystać do odróżnienia izomerów orto od izomerów para i meta. Przegrupowanie McLafferty'ego stosuje się do przegrupowania podwójnego wodoru. Reakcję tę obserwuje się dla trzech nienasyconych grup funkcyjnych, a mianowicie tioestrów, estrów i amidów.
Reakcja retro-Dielsa-Aldera
Reakcja ta zachodzi głównie w cykloheksenie i jego pochodnych. Po jonizacji elektrony pi są wzbudzane i generują miejsce ładunku i miejsce rodnika. Następnie dwa kolejne rozszczepienia α dają rodnik butadienu i obojętny eten, ponieważ eten ma wyższą energię jonizacji niż butadien (reguły Stevensona).

Reakcja cykloeliminacji
Reakcja ta zachodzi głównie w czteroczłonowych cząsteczkach cyklicznych. Po zjonizowaniu wytwarza jon dystoniczny, a następnie dalsze fragmenty, dając jon rodnika etenowego i obojętną cząsteczkę etenu.
Wzory fragmentacji poszczególnych klas związków
alkany
W przypadku alkanów liniowych często obserwuje się piki jonów molekularnych. Jednak w przypadku związków o długim łańcuchu intensywność pików jonów cząsteczkowych jest często słaba. Fragmenty liniowe często różnią się o 14 Da (CH2 = 14). Na przykład wzory fragmentacji heksanu. Kation butylowy m/z=57 jest pikiem podstawowym, a inne najliczniejsze piki w widmie to karbokationy alkilowe przy m/z=15, 29, 43 Da.
Rozgałęzione alkany mają nieco słabsze piki jonów cząsteczkowych w widmach. Mają tendencję do fragmentacji w punkcie rozgałęzienia. Dla 2,3-dimetylobutanu pik kationu izopropylu (m/z=43) jest bardzo silny.
Cykloalkany mają stosunkowo intensywne piki jonów molekularnych (dwa wiązania muszą zostać zerwane). Piki fragmentacji alkenu są często najbardziej znaczącym trybem. Utrata „CH 2 CH 2 ” (= 28) jest powszechna, jeśli występuje. Jednak w przypadku podstawionych cykloalkanów wolą tworzyć kationy cykloalkilowe przez rozszczepienie w punktach rozgałęzienia.
alkeny
Alkeny często wytwarzają silniejsze piki jonów molekularnych niż alkany ze względu na niższą energię jonizacji elektronu pi niż elektronu σ. Po jonizacji podwójne wiązania mogą łatwo migrować, co powoduje prawie niemożliwe oznaczenie izomerów. Rozszczepienie allilowe jest najbardziej znaczącym trybem fragmentacji ze względu na stabilizację rezonansu.
Możliwe są przegrupowania typu McLafferty'ego (podobne do wiązań karbonylowych pi). Ponownie możliwa jest migracja wiązań.
Cyklohekseny często przechodzą reakcje retro Dielsa-Aldera.
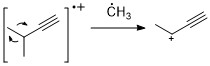
alkiny
Podobnie jak alkeny, alkiny często wykazują silny pik jonów cząsteczkowych. Rozszczepienie propargilowe jest najbardziej znaczącym trybem fragmentacji.
Aromatyczne węglowodory
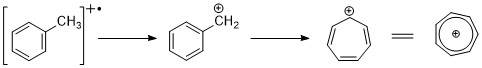
Węglowodory aromatyczne wykazują wyraźny pik jonów cząsteczkowych. Rozszczepienie benzylowe jest dość powszechne. Gdy grupy alkilowe są przyłączone do pierścienia, korzystnym sposobem rozszczepienia jest utrata rodnika H i utworzenie kationu tropylium (m/z 91).
Alkilo-podstawione benzeny mogą rozpadać się w procesie kontrolowanym kinetycznie, tworząc jony C 6 H 5 + , C 6 H 6 + .
Innym powszechnym sposobem fragmentacji jest przegrupowanie McLafferty'ego, które wymaga, aby długość łańcucha alkilowego była co najmniej dłuższa niż 3 atomy węgla.
Alkohole
Alkohole na ogół mają słabe piki jonów cząsteczkowych z powodu silnej elektroujemności tlenu. Rozszczepienie „alfa” jest powszechne ze względu na stabilizację rezonansu. Największa grupa alkilowa zostanie utracona.
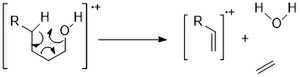
Innym powszechnym trybem fragmentacji jest odwodnienie (M-18). W przypadku alkoholi o dłuższych łańcuchach przegrupowanie typu McLafferty'ego może wytworzyć wodę i etylen (M-46).
Alkohole cykliczne mają tendencję do wykazywania silniejszych pików M+ niż łańcuchy liniowe. I podążają podobnymi ścieżkami fragmentacji: rozszczepieniem alfa i odwodnieniem.
Fenol
Fenol wykazuje silny pik jonów molekularnych. Obserwuje się utratę H· (M – 1), CO (M – 28) i rodników formylowych (HCO·, M – 29).
Eter
Etery wytwarzają nieco bardziej intensywne piki jonów cząsteczkowych w porównaniu z odpowiednimi alkoholami lub alkanami. Istnieją dwa popularne tryby rozszczepiania. Rozszczepienie α i rozszczepienie wiązania CO.
H
Etery aromatyczne mogą generować jon C6H5O+ przez utratę grupy alkilowej zamiast H; może to wydalić CO, jak w przypadku degradacji fenoli.
Związki karbonylowe
Istnieje pięć rodzajów związków karbonylowych, w tym aldehydy, ketony, kwasy karboksylowe i estry. Główne tryby fragmentacji są opisane w następujący sposób:
Rozszczepienie alfa może wystąpić po obu stronach karbonylowej grupy funkcyjnej, ponieważ samotna para tlenu może stabilizować ładunek dodatni.
Rozszczepienie β jest charakterystycznym sposobem fragmentacji związków karbonylowych w wyniku stabilizacji rezonansowej.
W przypadku związków karbonylowych o dłuższym łańcuchu (liczba atomów węgla jest większa niż 4) dominują przegrupowania McLafferty'ego.
Zgodnie z tymi schematami fragmentacji, charakterystyczne piki związków karbonylowych podsumowano w poniższej tabeli.
| zaobserwowano m/z jonu | ||||||
| Podział | Ścieżka | aldehydy G = H |
Ketony G=CH 3 |
estry G=OCH 3 |
Kwasy G = OH |
Amidy G = NH2 |
| Rozszczepienie alfa | Utrata rodnika R | 29 | 43 | 59 | 45 | 44 |
| Rozszczepienie alfa | Utrata rodnika G | M-1 | M-15 | M-59 | M-45 | M-44 |
| Rozszczepienie beta | M-43 | M-57 | M-73 | M-59 | M-58 | |
| przegrupowanie McLafferty'ego | 44 | 58 | 74 | 60 | 59 | |
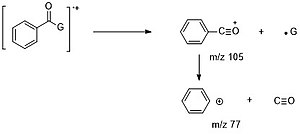
W przypadku aromatycznych związków karbonylowych rozszczepienia alfa sprzyjają przede wszystkim utracie G· (M – 1,15, 29…) w celu utworzenia jonu C6H5CO+ (m/z=105), który może dalej tracić CO (m/z= 77) i HCCH (m/z=51).
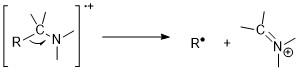
Aminy
Aminy podlegają zasadzie azotu. Nieparzysty stosunek masy do ładunku jonów cząsteczkowych sugeruje istnienie nieparzystej liczby atomów azotu. Niemniej jednak piki jonów molekularnych są słabe w aminach alifatycznych ze względu na łatwość fragmentacji obok amin. Reakcje rozszczepienia alfa są najważniejszym trybem fragmentacji amin; dla 1° amin n-alifatycznych występuje intensywny pik przy m/z 30.
Aminy aromatyczne mają intensywne piki jonów molekularnych. W przypadku anilin wolą stracić atom wodoru przed wydaleniem HCN.
Nitryle
Podstawowym trybem fragmentacji jest utrata atomu H (M – 1) z węgla obok grupy CN w wyniku stabilizacji rezonansu. Przegrupowanie McLafferty'ego można zaobserwować, gdy mają dłuższe łańcuchy.
Związki nitrowe
Alifatyczne nitrozwiązki zwykle wykazują słabe piki jonów cząsteczkowych, podczas gdy aromatyczne nitrozwiązki dają silny pik. Typowym trybem degradacji jest utrata NO + i NO 2+ .
Elektrorozpylanie i jonizacja chemiczna pod ciśnieniem atmosferycznym
Elektrorozpylanie i jonizacja chemiczna pod ciśnieniem atmosferycznym mają różne zasady interpretacji widma ze względu na różne mechanizmy jonizacji.
Zobacz też
- Component Detection Algorithm (CODA), algorytm stosowany w analizie danych spektrometrii mas
- Lista oprogramowania do spektrometrii mas