Fragmentacja (spektrometria mas)
W spektrometrii mas fragmentacja to dysocjacja niestabilnych energetycznie jonów cząsteczkowych powstałych w wyniku przechodzenia cząsteczek w komorze jonizacyjnej spektrometru mas. Fragmenty cząsteczki tworzą unikalny wzór w widmie masowym . Reakcje te są dobrze udokumentowane przez dziesięciolecia, a wzorzec fragmentacji jest przydatny do określenia masy molowej i informacji strukturalnych nieznanej cząsteczki. Fragmentacja występująca w eksperymentach z tandemową spektrometrią mas była ostatnio przedmiotem badań, ponieważ dane te ułatwiają identyfikację cząsteczek.
Techniki spektrometrii mas
Fragmentacja może wystąpić w źródle jonów (fragmentacja w źródle), gdzie była używana z jonizacją elektronową w celu pomocy w identyfikacji cząsteczek, a ostatnio (2020) z jonizacją przez elektrorozpylanie wykazano, że zapewnia te same korzyści w ułatwianiu identyfikacji molekularnej. Przed tymi eksperymentami fragmentacja w źródle jonizacji przez elektrorozpylanie była ogólnie uważana za efekt niepożądany, jednak wykazano, że jonizacja przez elektrorozpylanie przy użyciu ulepszonej fragmentacji / adnotacji w źródle (EISA) sprzyja fragmentacji w źródle, która tworzy jony fragmentacyjne, które są zgodne z tandemem spektrometry masowe. Fragmentacja generowana przez tandemową spektrometrię mas jest zwykle wykonywana w strefie kolizji (fragmentacja po źródle) a tandemowy spektrometr masowy . EISA i dysocjacja wywołana kolizją (CID) wśród innych zdarzeń fizycznych, które wpływają na jony, są częścią chemii jonów w fazie gazowej . Kilka różnych rodzajów fragmentacji masy to dysocjacja indukowana kolizją (CID) poprzez zderzenie z cząsteczką obojętną, dysocjacja indukowana powierzchniowo (SID) przy użyciu zderzenia szybko poruszających się jonów z powierzchnią stałą, dysocjacja indukowana laserem, która wykorzystuje laser do indukowania tworzenia jonów, dysocjacja z wychwytem elektronów (ECD) w wyniku wychwytywania elektronów o niskiej energii, dysocjacja z przeniesieniem elektronu (ETD) poprzez przenoszenie elektronów między jonami, ujemną dysocjację z przeniesieniem elektronu (NETD), dysocjację z oderwaniem elektronów (EDD), fotodysocjację , w szczególności dysocjację wielofotonową w podczerwieni (IRMPD) z wykorzystaniem promieniowania IR do bombardowania i dysocjację promieniowania podczerwonego ciała doskonale czarnego (BIRD), która używać promieniowania podczerwonego zamiast lasera, wysokoenergetycznej dysocjacji pułapki C (HCD), EISA i zdalnej fragmentacji ładunku .
Reakcje fragmentacji
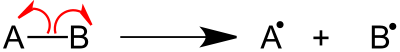
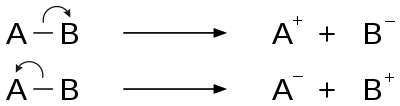
Fragmentacja to rodzaj dysocjacji chemicznej, w której usunięcie elektronu z cząsteczki powoduje jonizację. Usunięcie elektronów z wiązania sigma, wiązania pi lub niezwiązanych orbitali powoduje jonizację. Może to nastąpić w procesie homolitycznego rozszczepienia lub homolizy lub heterolitycznego rozszczepienia lub heterolizy wiązania. Względna energia wiązania i zdolność do ulegania korzystnym cyklicznym stanom przejściowym wpływają na proces fragmentacji. Reguły podstawowych procesów fragmentacji określa reguła Stevensona.
Dwie główne kategorie wzorców rozszczepiania wiązań to proste reakcje rozszczepiania wiązań i reakcje przegrupowania.
Proste reakcje rozrywania wiązań
Większość związków organicznych ulega prostym reakcjom rozerwania wiązania, w których następuje bezpośrednie rozerwanie wiązania. Rozszczepienie wiązania sigma, fragmentacja inicjowana przez rodniki i fragmentacja inicjowana przez miejsce ładunku to kilka typów prostych reakcji rozszczepienia wiązania.
Rozszczepienie wiązania sigma / rozszczepienie σ
Rozszczepienie wiązania sigma jest najczęściej obserwowane w cząsteczkach, które mogą wytwarzać stabilne kationy, takie jak nasycone alkany , drugorzędowe i trzeciorzędowe karbokationy . Dzieje się tak, gdy elektron alfa zostaje usunięty. Wiązanie CC wydłuża się i osłabia powodując fragmentację. Fragmentacja w tym miejscu daje naładowany i neutralny fragment.
Radykalna fragmentacja inicjowana przez miejsce
Rozszczepienie wiązania sigma występuje również na rodnikowych kationach oddalonych od miejsca jonizacji. Jest to powszechnie obserwowane w alkoholach , eterach , ketonach , estrach , aminach , alkenach i związkach aromatycznych z węglem przyłączonym do pierścienia. Kation ma rodnik na heteroatomie lub nienasyconą grupę funkcyjną. Siłą napędową fragmentacji jest silna tendencja jonu rodnikowego do tworzenia par elektronów. Rozszczepienie następuje, gdy rodnik i nieparzysty elektron z wiązań sąsiadujących z rodnikiem migrują, tworząc wiązanie między węglem alfa a heteroatomem lub nienasyconą grupą funkcyjną. pęka wiązanie sigma; stąd to rozszczepienie jest również znane jako rozszczepienie wiązania homolitycznego lub rozszczepienie α.
Rozszczepienie inicjowane przez miejsce ładowania
Siłą napędową fragmentacji inicjowanej przez miejsce ładunku jest efekt indukcyjny miejsca ładunku w rodnikowych kationach. Elektrony z wiązania sąsiadującego z atomem przenoszącym ładunek migrują do tego atomu, neutralizując pierwotny ładunek i powodując jego przeniesienie w inne miejsce. Termin ten jest również nazywany rozszczepieniem indukcyjnym i jest przykładem rozerwania wiązania heterolitycznego.
Reakcje przegrupowania
Reakcje przegrupowania to reakcje fragmentacji, które tworzą nowe wiązania, tworząc strukturę pośrednią przed rozszczepieniem. Jedną z najlepiej zbadanych reakcji przegrupowania jest przegrupowanie McLafferty'ego / przegrupowanie γ-wodoru. Dzieje się tak w rodnikowych kationach z nienasyconymi grupami funkcyjnymi, takimi jak ketony , aldehydy , kwasy karboksylowe , estry , amidy , olefiny , fenyloalkany. Podczas tej reakcji γ-wodór najpierw przejdzie do grupy funkcyjnej, a następnie nastąpi rozszczepienie wiązania α, β związku pośredniego. Inne reakcje przegrupowania obejmują rozszczepienie pierścienia heterocyklicznego (HRF), rozszczepienie tworzące benzofuran (BFF), chinonu metydu (QM) lub Retro Dielsa-Aldera (RDA).
Zobacz też
Linki zewnętrzne
- Wzorce fragmentacji w widmach masowych związków organicznych
- Samouczek dotyczący identyfikacji małych cząsteczek za pomocą spektrometrii mas z jonizacją przez elektrorozpylanie: praktyczna sztuka wyjaśniania struktur