Dysocjacja z przeniesieniem elektronów
Dysocjacja z przeniesieniem elektronów ( ETD ) to metoda fragmentacji wielokrotnie naładowanych gazowych makrocząsteczek w spektrometrze mas pomiędzy etapami tandemowej spektrometrii mas (MS/MS). Podobnie jak dysocjacja z wychwytem elektronów , ETD indukuje fragmentację dużych, wielokrotnie naładowanych kationów , przenosząc do nich elektrony . ETD jest szeroko stosowany z polimerami i cząsteczkami biologicznymi, takimi jak białka i peptydy do analizy sekwencji . Przeniesienie elektronu powoduje szkieletu peptydowego na jony c i z, pozostawiając nietrwałe modyfikacje potranslacyjne (PTM) w stanie nienaruszonym. Technika działa dobrze tylko w przypadku peptydów lub jonów polimerowych o wyższym stanie naładowania (z>2). Jednak w porównaniu z dysocjacją wywołaną kolizją (CID), ETD jest korzystna dla fragmentacji dłuższych peptydów lub nawet całych białek. To sprawia, że technika ta jest ważna dla proteomiki odgórnej . Metoda została opracowana przez Hunta i współpracowników z University of Virginia .
Historia
Dysocjacja z wychwytem elektronów (ECD) została opracowana w 1998 r. W celu fragmentacji dużych białek do analizy spektrometrii mas. Ponieważ ECD wymaga dużej ilości elektronów zbliżonych do termicznych (<0,2 eV), pierwotnie był używany wyłącznie ze spektrometrią mas rezonansu cyklotronowego z transformacją Fouriera (FTICR), najdroższą formą oprzyrządowania MS. Mniej kosztowne opcje, takie jak z kwadrupolowym czasem przelotu (Q-TOF), kwadrupolową pułapką jonową (QIT) i liniową kwadrupolową pułapką jonową (QLT), wykorzystywały bardziej energochłonną metodę dysocjacji wywołanej kolizją (CID), co skutkowało losowymi fragmentacja peptydów i białek. W 2004 roku Syka i in. ogłosiła stworzenie ETD, metody dysocjacji podobnej do ECD, ale wykorzystującej niedrogi, powszechnie dostępny komercyjny spektrometr. Pierwsze eksperymenty ETD przeprowadzono na spektrometrze masowym QLT ze jonizacji przez elektrorozpylanie (ESI).
Zasada działania
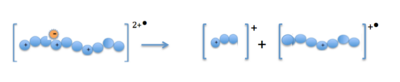
Dysocjacja z przeniesieniem elektronu obejmuje kilka etapów. Zwykle mieszaninę białek rozdziela się najpierw za pomocą wysokosprawnej chromatografii cieczowej (HPLC). Kolejne wielokrotnie protonowane cząsteczki prekursorów są generowane przez jonizację przez elektrorozpylanie i wstrzykiwane do spektrometru mas. (Tylko cząsteczki o ładunku 2+ lub większym mogą być użyte w ETD.) Aby elektron został przeniesiony do dodatnich cząsteczek prekursorowych, generowane są rodniki aniony i umieszczane wraz z nimi w pułapce jonowej. Podczas reakcji jon/jon elektron jest przenoszony na dodatnio naładowane białko lub peptyd, powodując fragmentację wzdłuż szkieletu peptydowego. Na koniec otrzymane fragmenty poddaje się analizie masowej.
Przygotowanie radykalnych anionów
W oryginalnych eksperymentach ETD antracen (C 14 H 10 ) był używany do generowania reaktywnych anionów rodnikowych poprzez ujemną jonizację chemiczną . W kolejnych eksperymentach wykorzystano kilka cząsteczek wielopierścieniowych węglowodorów aromatycznych , przy czym obecnie preferowanym odczynnikiem jest fluoranten . Fluoranten ma jednak tylko około 40% skuteczność w przenoszeniu elektronów, dlatego poszukiwane są inne cząsteczki o niskim powinowactwie elektronowym.
Iniekcja i fragmentacja
Kiedy kationy prekursorowe (białka lub peptydy) i rodnikowe aniony są połączone w pułapce jonowej, elektron jest przenoszony do wielokrotnie naładowanego kationu. Tworzy to niestabilny dodatni rodnikowy kation z jednym ładunkiem dodatnim mniej i nieparzystym elektronem. Fragmentacja zachodzi wzdłuż szkieletu peptydowego przy wiązaniu N-Cα, w wyniku czego powstają jony fragmentacyjne typu c i z.
Analiza masy
Fragmentacja spowodowana przez ETD umożliwia uzyskanie pełniejszych informacji o sekwencji białek z widm ETD niż z tandemowej spektrometrii mas CID. Ponieważ wykrywa się wiele jonów typu c i z szkieletu peptydowego, na podstawie widm fragmentacji ETD można dostrzec prawie całkowite pokrycie sekwencji wielu peptydów. Sekwencje 15-40 aminokwasów zarówno na N-końcu, jak i C-końcu białka można odczytać za pomocą masy do ładunku dla pojedynczo i podwójnie naładowanych jonów. Sekwencje te, wraz ze zmierzoną masą nienaruszonego białka, można porównać z wpisami w bazie danych dla znanych białek i ujawnić modyfikacje potranslacyjne.
Oprzyrządowanie
Dysocjacja z przeniesieniem elektronu zachodzi w spektrometrze mas z pułapką jonową ze źródłem jonizacji przez elektrorozpylanie. Pierwsze eksperymenty ETD na Uniwersytecie Wirginii wykorzystywały kwadrupolową liniową pułapkę jonową o częstotliwości radiowej (LQT) zmodyfikowaną źródłem jonizacji chemicznej (CI) z tyłu instrumentu (patrz diagram po prawej). Ponieważ widmo można uzyskać w około 300 milisekund, chromatografia cieczowa jest często połączona z ETD MS/MS. Wadą stosowania LQT jest to, że zdolność rozdzielcza mas jest mniejsza niż w przypadku innych spektrometrów mas.
W kolejnych badaniach wypróbowano inne oprzyrządowanie w celu poprawy rozdzielczości masy. Posiadanie ujemnego źródła CI z tyłu instrumentu zakłócało działanie analizatora o wysokiej rozdzielczości w LQT-Orbitrap i kwadrupolowym czasie przelotu (QTOF), dlatego wprowadzono alternatywne metody jonizacji anionów rodnikowych.
W 2006 roku grupa z Purdue University kierowana przez Scotta McLuckeya użyła tandemowego spektrometru masowego kwadrupolowego / czasu przelotu (QqTOF) z pulsacyjnym źródłem podwójnej jonizacji chemicznej nano-ESI / jonizacji chemicznej pod ciśnieniem atmosferycznym (APCI), wykorzystując rodnikowe aniony 1,3- dinitrobenzen jako donor elektronów. Później laboratorium na Uniwersytecie Wisconsin zaadaptowało hybrydowy kwadrupolowy spektrometr masowy z liniową pułapką jonową i orbitą do wykorzystania ETD. W tej metodzie wykorzystano również metodę jonizacji front-end dla rodnikowych anionów kwasu 9-antracenokarboksylowego za pośrednictwem pulsacyjnych źródeł podwójnego ESI.
Ponieważ ETD jest coraz bardziej popularny w analizie struktury białek i peptydów, wdrażanie go na łatwo dostępnych spektrometrach mas z pułapką jonową w połączeniu z analizatorami mas o wysokiej rozdzielczości wciąż ewoluuje.
Aplikacje
Proteomika
ETD jest szeroko stosowany w analizie białek i dużych peptydów. Wszystkie ważne modyfikacje potranslacyjne, w tym fosforylacja , glikozylacja i wiązania dwusiarczkowe, są analizowane przy użyciu ETD.
Chemia polimerów
Chociaż analizy polimerów oparte na MS były w dużej mierze wykonywane przy użyciu jednoetapowego MS, tandem MS był również używany do charakteryzowania składników polimerowych. CID jest najczęściej stosowaną metodą dysocjacji, ale ETD została wykorzystana jako metoda uzupełniająca. Unikalne rozerwania wiązań wynikające z ETD dostarczają cennych informacji diagnostycznych.