Kataliza fotoredoks
Kataliza fotoredoks jest gałęzią fotochemii wykorzystującą transfer pojedynczego elektronu . Katalizatory fotoredoks są generalnie pobierane z trzech klas materiałów: kompleksów metali przejściowych, barwników organicznych i półprzewodników . Podczas gdy organiczne katalizatory fotoredoks dominowały w latach 90. i na początku XXI wieku, obecnie częściej stosuje się rozpuszczalne kompleksy metali przejściowych.
Fotochemia sensybilizatorów metali przejściowych
Uczulacze pochłaniają światło, dając stany wzbudzone aktywne redoks. W przypadku wielu sensybilizatorów na bazie metali wzbudzenie jest realizowane jako przeniesienie ładunku z metalu na ligand , podczas którego elektron przemieszcza się z metalu (np. orbital ad) na orbital zlokalizowany na ligandach (np. orbital π * ligandu aromatycznego). Początkowy wzbudzony stan elektroniczny relaksuje się do stanu wzbudzonego singletem o najniższej energii poprzez wewnętrzną konwersję , proces, w którym energia jest rozpraszana jako energia wibracyjna, a nie jako promieniowanie elektromagnetyczne. Ten stan wzbudzony singletem może ulec dalszemu rozluźnieniu w wyniku dwóch różnych procesów: katalizator może fluoryzować , wypromieniowując foton i wracając do singletowego stanu podstawowego, lub może przejść do stanu wzbudzonego trypletu o najniższej energii (stan, w którym dwa niesparowane elektrony mają ten sam spin) w drugim niepromienistym procesie zwanym przejściem międzysystemowym .
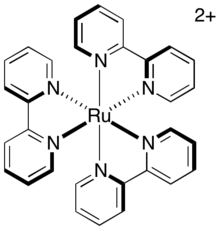
Bezpośrednia relaksacja wzbudzonego trypletu do stanu podstawowego, nazywana fosforescencją , wymaga zarówno emisji fotonu, jak i odwrócenia spinu wzbudzonego elektronu. Ta ścieżka jest powolna, ponieważ jest zakaz spinania, więc stan wzbudzony trypletem ma znaczną średnią żywotność. Dla zwykłego fotosensybilizatora, tris-(2,2'-bipirydylo) rutenu (w skrócie [Ru(bipy) 3 ] 2+ lub [Ru(bpy) 3 ] 2+ ), czas życia trypletowego stanu wzbudzonego wynosi około 1100 ns. Ten czas życia jest wystarczający, aby inne ścieżki relaksacji (w szczególności ścieżki przenoszenia elektronów) zaszły przed rozpadem katalizatora do stanu podstawowego.
Długo żyjący trypletowy stan wzbudzony dostępny przez fotowzbudzenie jest zarówno silniejszym środkiem redukującym , jak i silniejszym środkiem utleniającym niż stan podstawowy katalizatora. Ponieważ sensybilizator jest nasycony koordynacyjnie, transfer elektronów musi zachodzić w sfery zewnętrznej , w którym elektrony tunelują między katalizatorem a podłożem.
Przenoszenie elektronów sfery zewnętrznej
Marcusa dotycząca przenoszenia elektronów w sferze zewnętrznej przewiduje, że taki proces tunelowania zajdzie najszybciej w układach, w których przenoszenie elektronów jest termodynamicznie korzystne (tj. pomiędzy silnymi reduktorami i utleniaczami) iw których przenoszenie elektronów ma niską wewnętrzną barierę.
Wewnętrzna bariera przenoszenia elektronów wywodzi się z zasady Francka-Condona , zgodnie z którą przejście elektronowe zachodzi szybciej, biorąc pod uwagę większe nakładanie się początkowych i końcowych stanów elektronowych. Interpretowana luźno, zasada ta sugeruje, że bariera przejścia elektronicznego jest związana ze stopniem, w jakim system dąży do reorganizacji. W przypadku przejścia elektronicznego z układem bariera jest związana z „nakładaniem się” między początkową i końcową funkcją falową wzbudzonego elektronu, tj. stopniem, w jakim elektron musi „przemieścić się” w przejściu.
W międzycząsteczkowym transferze elektronów podobną rolę odgrywa stopień, w jakim jądra starają się poruszać w odpowiedzi na zmianę ich nowego środowiska elektronicznego. Bezpośrednio po przeniesieniu elektronu układ jądrowy cząsteczki, poprzednio będący w równowadze, teraz reprezentuje stan wzbudzony wibracyjnie i musi rozluźnić się do swojej nowej geometrii równowagi. Sztywne układy, których geometria nie jest w dużym stopniu zależna od stopnia utlenienia, doświadczają zatem mniejszego wzbudzenia wibracyjnego podczas przenoszenia elektronów i mają niższą wewnętrzną barierę. Fotokatalizatory, takie jak [Ru(bipy) 3 ] 2+ , są utrzymywane w sztywnym układzie przez płaskie, dwukleszczowe ligandy ułożone w oktaedrycznej geometrii wokół metalowego środka. Dlatego kompleks nie ulega dużej reorganizacji podczas przenoszenia elektronów. Ponieważ przenoszenie elektronów w tych kompleksach jest szybkie, prawdopodobnie nastąpi w czasie trwania stanu aktywnego katalizatora, czyli w czasie życia trypletowego stanu wzbudzonego.
Regeneracja katalizatora
Aby zregenerować stan podstawowy, katalizator musi uczestniczyć w drugim transferze elektronów poza sferę zewnętrzną. W wielu przypadkach ten transfer elektronów odbywa się za pomocą stechiometrycznego dwuelektronowego reduktora lub utleniacza, chociaż w niektórych przypadkach ten etap obejmuje drugi odczynnik.
Ponieważ etap przeniesienia elektronu w cyklu katalitycznym odbywa się ze stanu wzbudzonego trypletem, konkuruje on z fosforescencją jako ścieżka relaksacji. Eksperymenty Sterna-Volmera mierzą intensywność fosforescencji, zmieniając stężenie każdego możliwego środka gaszącego. Gdy zmienia się stężenie rzeczywistego środka wygaszającego, wpływa to na szybkość przenoszenia elektronów i stopień fosforescencji. Zależność tę modeluje równanie:
00 Tutaj I i I oznaczają intensywność emisji z obecnością środka wygaszającego i bez niego, k q stałą szybkości procesu wygaszania, τ czas życia w stanie wzbudzonym pod nieobecność środka wygaszającego oraz [Q] stężenie środka wygaszającego. Tak więc, jeśli czas życia katalizatora fotoredoks w stanie wzbudzonym jest znany z innych eksperymentów, stałą szybkości wygaszania w obecności pojedynczego składnika reakcji można określić, mierząc zmianę intensywności emisji, gdy zmienia się stężenie środka wygaszającego.
Właściwości fotofizyczne
Potencjały redoks
Potencjały redoks katalizatorów fotoredoks muszą być dopasowane do innych składników reakcji. Podczas gdy potencjały redoks w stanie podstawowym można łatwo zmierzyć za pomocą woltamperometrii cyklicznej lub innymi metodami elektrochemicznymi, pomiaru potencjału redoks elektronicznie wzbudzonego stanu nie można przeprowadzić bezpośrednio tymi metodami. Istnieją jednak dwie metody, które umożliwiają oszacowanie potencjałów redoks w stanie wzbudzonym i istnieje jedna metoda bezpośredniego pomiaru tych potencjałów. Aby oszacować potencjały redoks w stanie wzbudzonym, jedną z metod jest porównanie szybkości przenoszenia elektronów ze stanu wzbudzonego do szeregu reagentów w stanie podstawowym, których potencjały redoks są znane. Bardziej powszechną metodą szacowania tych potencjałów jest użycie równania opracowanego przez Rehma i Wellera, które opisuje potencjały stanu wzbudzonego jako poprawkę potencjałów stanu podstawowego:
W tych wzorach E* 1/2 reprezentuje potencjał redukcji lub utleniania stanu wzbudzonego, E 1/2 reprezentuje potencjał redukcji lub utleniania stanu podstawowego, E 0,0 reprezentuje różnicę energii między zerowymi stanami wibracyjnymi stanu podstawowego i wzbudzonego, a wr reprezentuje pracę wyjścia , oddziaływanie elektrostatyczne, które powstaje w wyniku rozdzielenia ładunków, które zachodzi podczas przenoszenia elektronów między dwoma rodzajami związków chemicznych. Zerowa energia wzbudzenia, E 0,0 jest zwykle aproksymowana przez odpowiednie przejście w widmie fluorescencyjnym. Ta metoda umożliwia obliczenie przybliżonych potencjałów redoks w stanie wzbudzonym na podstawie łatwiejszych do zmierzenia potencjałów redoks w stanie podstawowym i danych spektroskopowych.
Bezpośredni pomiar potencjałów redoks w stanie wzbudzonym jest możliwy dzięki zastosowaniu metody zwanej woltamperometrią z modulacją fazową . Ta metoda polega na oświetlaniu ogniwa elektrochemicznego światłem w celu wygenerowania pożądanych form stanu wzbudzonego, ale w celu sinusoidalnej modulacji natężenia światła , tak aby stężenie substancji w stanie wzbudzonym nie było stałe. W rzeczywistości stężenie substancji w stanie wzbudzonym w ogniwie powinno zmieniać się dokładnie w fazie wraz z intensywnością światła padającego na ogniwo elektrochemiczne. Jeśli potencjał przyłożony do ogniwa jest wystarczająco silny, aby nastąpił transfer elektronów, zmianę stężenia stanu wzbudzonego zdolnego do reakcji redoks można zmierzyć jako prąd przemienny (AC). Ponadto przesunięcie fazowe prądu przemiennego w stosunku do intensywności padającego światła odpowiada średniemu czasowi życia gatunku w stanie wzbudzonym, zanim zaangażuje się on w przeniesienie elektronów.
Wykresy potencjałów redoks dla najpopularniejszych katalizatorów fotoredoks są dostępne do szybkiego dostępu.
Elektroujemność liganda
Względny charakter redukujący i utleniający tych fotokatalizatorów można zrozumieć, biorąc pod uwagę elektroujemność ligandów i metaliczne centrum kompleksu katalizatora. Bardziej elektroujemne metale i ligandy mogą stabilizować elektrony lepiej niż ich mniej elektroujemne odpowiedniki. Dlatego kompleksy z ligandami bardziej elektroujemnymi są bardziej utleniające niż kompleksy ligandów mniej elektroujemnych. Na przykład ligandy 2,2'-bipirydyna i 2,2'-fenylopirydyna są strukturami izoelektronowymi, zawierającymi tę samą liczbę i układ elektronów. fenylopirydyna zastępuje jeden z atomów azotu w bipirydynie atomem węgla. Węgiel jest mniej elektroujemny niż azot, więc mniej mocno trzyma elektrony. Ponieważ pozostała część cząsteczki liganda jest identyczna, a fenylopirydyna wiąże elektrony słabiej niż bipirydyna, jest silniej oddającym elektrony i mniej elektroujemnym jako ligand. Dlatego kompleksy z ligandami fenylopirydynowymi są silniej redukujące i słabiej utleniające niż równoważne kompleksy z ligandami bipirydynowymi.
Podobnie, fluorowany ligand fenylopirydynowy jest bardziej elektroujemny niż fenylopirydyna, więc kompleksy z ligandami zawierającymi fluor są silniej utleniające i mniej silnie redukujące niż równoważne niepodstawione kompleksy fenylopirydynowe. Elektroniczny wpływ centrum metalu na kompleks jest bardziej złożony niż efekt ligandu. Według elektroujemności Paulinga zarówno ruten , jak i iryd mają elektroujemność 2,2. Gdyby był to jedyny czynnik istotny dla potencjałów redoks, to kompleksy rutenu i irydu z tymi samymi ligandami powinny być równie silnymi katalizatorami fotoredoks. Jednak biorąc pod uwagę równanie Rehma-Wellera, właściwości spektroskopowe metalu odgrywają rolę w określaniu właściwości redoks stanu wzbudzonego. W szczególności parametr E 0,0 jest związana z długością fali emisji kompleksu, a zatem z wielkością przesunięcia Stokesa - różnicy energii między maksymalną absorpcją a emisją cząsteczki. Zazwyczaj kompleksy rutenu mają duże przesunięcia Stokesa, a co za tym idzie, fale emisji o niskiej energii i małe energie wzbudzenia zero-zero w porównaniu z kompleksami irydu. W efekcie, podczas gdy kompleksy rutenu w stanie podstawowym mogą być silnymi reduktorami, kompleks w stanie wzbudzonym jest znacznie słabszym reduktorem lub utleniaczem niż jego równoważny kompleks irydu. To sprawia, że iryd jest preferowany do rozwoju ogólnych przemian organicznych, ponieważ silniejsze potencjały redoks wzbudzonego katalizatora pozwalają na użycie słabszych stechiometrycznych reduktorów i utleniaczy lub użycie mniej reaktywnych substratów.
Tożsamość przeciwjonowa
Często zdarza się, że te fotokatalizatory są zrównoważone przeciwjonem, jak ma to miejsce w przypadku przykładowego kompleksu tris-(2,2'-bipirydylo)rutenu , któremu towarzyszą dwa aniony w celu zrównoważenia całkowitego ładunku pary jonowej do zera. Istnieją jednak katalizatory fotoredoks z metali przejściowych, które istnieją bez przeciwjonu, takie jak tris(2-fenylopirydyno)iryd (często w skrócie Ir(ppy) 3 ). Znaczenie tych przeciwjonów zależy od asocjacji jonów między katalizatorem fotoredoks a jego przeciwjonem (jonami) i zależy od rozpuszczalnika użyte do reakcji. Chociaż właściwości fotofizyczne, takie jak potencjał redoks, energia wzbudzenia i elektroujemność ligandu, były często uważane za kluczowe parametry stosowania i reaktywności tych kompleksów, wykazano, że tożsamość przeciwjonu odgrywa znaczącą rolę w rozpuszczalnikach o niskiej polarności . W szczególności wykazano, że posiadanie ściśle związanego przeciwjonu zwiększa szybkość przenoszenia elektronów podczas redukcji substratu, ale znacznie zmniejsza szybkość przenoszenia elektronów podczas utleniania substratu. Uważa się, że dzieje się tak, ponieważ przeciwjon zasadniczo „blokuje” przenoszenie elektronów do kompleksu fotoredoks, osłaniając bardziej dodatnio naładowany obszar kompleksu; mając na uwadze, że posiadanie ścisłego asocjacji przeciwjonowej popycha gęstość elektronów dalej od metalowego środka katalizatora fotoredoks, ułatwiając przeniesienie z katalizatora (oczywiście dotyczy to tylko przypadku, gdy katalizator fotoredoks jest kationem, a przeciwjon jest anionem ). Tożsamość przeciwjonu jest zatem dodatkowym parametrem, który należy wziąć pod uwagę przy opracowywaniu nowych reakcji fotoredoks.
Aplikacje
Dehalogenacja redukcyjna
Najwcześniejsze zastosowania katalizy fotoredoks do dehalogenacji redukcyjnej były ograniczone przez wąski zakres substratów lub konkurencyjne sprzęganie redukcyjne.
Nieaktywowane wiązania węgiel-jod można zredukować za pomocą silnie redukującego fotokatalizatora tris-(2,2'- fenylopirydyno )irydu (Ir(ppy) 3 ). Zwiększony potencjał redukcyjny Ir(ppy) 3 w porównaniu z [Ru(bipy) 3 ] 2+ pozwala na bezpośrednią redukcję wiązania węgiel-jod bez interakcji ze stechiometrycznym reduktorem. W ten sposób kompleks irydu przenosi elektron na podłoże, powodując fragmentację podłoża i utlenianie katalizatora do stopnia utlenienia Ir(IV). Utleniony fotokatalizator jest przywracany do pierwotnego stanu utlenienia poprzez utlenianie dodatków reakcyjnych.
Podobnie jak reakcje rodnikowej dehalogenacji za pośrednictwem cyny, fotokatalityczna redukcyjna dehalogenacja może być wykorzystana do zainicjowania cyklizacji kaskadowych
Oksydacyjne wytwarzanie jonów iminiowych
iminiowe są silnymi elektrofilami przydatnymi do generowania wiązań CC w złożonych cząsteczkach. Jednak kondensacja amin ze związkami karbonylowymi w celu utworzenia jonów iminowych jest często niekorzystna i czasami wymaga surowych warunków odwadniania. Tak więc alternatywne metody generowania jonów iminiowych, zwłaszcza przez utlenianie z odpowiedniej aminy, są cennym narzędziem syntezy. Jony iminiowe można wytworzyć z aktywowanych amin za pomocą Ir(dtbbpy)(ppy) 2 PF 6 jako katalizator fotoredoksu. Proponuje się, aby ta przemiana zachodziła przez utlenianie aminy do kationu rodnika aminowego przez wzbudzony fotokatalizator. Po tym następuje przeniesienie atomu wodoru do superstechimetrycznego utleniacza, takiego jak rodnik trichlorometylowy (CCl3 tworzący jon iminiowy). Jon iminiowy jest następnie gaszony w reakcji z nukleofilem. Zbadano pokrewne przemiany amin z szeroką gamą innych nukleofili , takich jak cyjanek ( reakcja Streckera ), etery sililowo-enolowe ( reakcja Mannicha ), dialkilofosforany, allilosilany ( reakcja aza-Sakurai ), indole ( reakcja Friedela-Craftsa ), acetylenki miedzi.
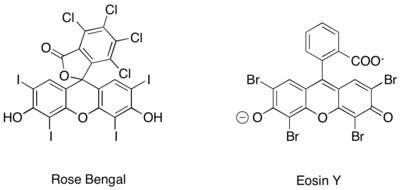
Podobną generację fotoredoks jonów iminiowych uzyskano ponadto przy użyciu czysto organicznych katalizatorów fotoredoks, takich jak róż bengalski i eozyna Y.
Asymetryczny wariant tej reakcji wykorzystuje acylowe równoważniki nukleofilowe generowane przez katalizę N-heterocyklicznego karbenu . Ta metoda reakcji omija problem słabej enancjoindukcji z chiralnych katalizatorów fotoredoks poprzez przeniesienie źródła enancjoselektywności do N-heterocyklicznego karbenu.
Oksydacyjne wytwarzanie jonów oksokarbeniowych
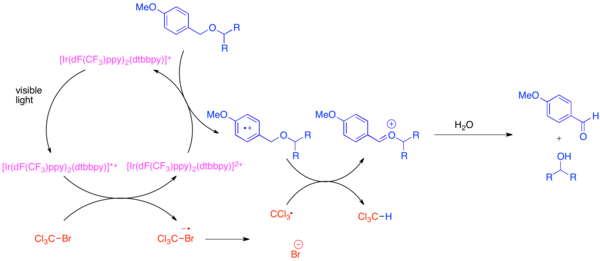
rozróżnienie każdego wystąpienia wspólnej grupy funkcyjnej, takiej jak grupa hydroksylowa , podczas syntezy złożonej cząsteczki. Bardzo powszechną grupą zabezpieczającą hydroksylową grupę funkcyjną jest eter para -metoksybenzylowy (PMB). Ta grupa zabezpieczająca jest chemicznie podobna do mniej bogatego w elektrony eteru benzylowego. Zazwyczaj selektywne rozszczepianie eteru PMB w obecności eteru benzylowego wykorzystuje silne utleniacze stechiometryczne, takie jak 2,3-dichloro-5,6-dicyjano-1,4-benzochinon (DDQ) lub azotan cerowo-amonowy (CAN). Etery PMB są znacznie bardziej podatne na utlenianie niż etery benzylowe, ponieważ są bogatsze w elektrony. Selektywne odbezpieczenie eterów PMB można osiągnąć poprzez zastosowanie heksafluorofosforanu bis-(2-(2',4'-difluorofenylo)-5-trifluorometylopirydyno)-(4,4'-ditertbutylobipirydyno)irydu(III) (Ir[dF(CF 3 )ppy] 2 (dtbbpy)PF 6 ) i łagodnego utleniacza stechiometrycznego , takiego jak bromotrichlorometan , BrCCl 3 . Fotoekscytowany katalizator irydowy jest wystarczająco redukujący, aby fragmentować bromotrichlorometan, tworząc rodnik trichlorometylowy, anion bromkowy i kompleks Ir (IV). Ubogie w elektrony fluorowane ligandy sprawiają, że kompleks irydu utlenia się na tyle, aby przyjąć elektron z areny bogatej w elektrony, takiej jak eter PMB. Po utlenieniu areny będzie chętnie uczestniczyć w przenoszeniu atomów wodoru z rodnikiem trichlorometylowym, tworząc chloroform i oksokarben jon, który łatwo ulega hydrolizie, odsłaniając wolny wodorotlenek. Wykazano, że ta reakcja jest ortogonalna w stosunku do wielu powszechnych grup zabezpieczających, gdy dodano zasadę w celu zneutralizowania wytworzonego HBr.
Cycloadditions
Cycloadditions i inne reakcje pericykliczne są potężnymi transformacjami w syntezie organicznej ze względu na ich potencjał do szybkiego generowania złożonych architektur molekularnych, a zwłaszcza ze względu na ich zdolność do ustawiania wielu sąsiednich stereocentrów w wysoce kontrolowany sposób. Jednak tylko niektóre cykloaddycje są dozwolone w warunkach termicznych zgodnie z symetrii orbity Woodwarda-Hoffmanna lub innymi równoważnymi modelami, takimi jak teoria orbitali molekularnych na granicy (FMO) lub model Dewara-Zimmermanna. Cykloaddycje, które nie są dozwolone termicznie, takie jak cykloaddycja [2 + 2], można włączyć przez fotochemiczną aktywację reakcji. W warunkach niekatalizowanych ta aktywacja wymaga użycia wysokoenergetycznego światła ultrafioletowego zdolnego do zmiany orbitalnych populacji reaktywnych związków. Alternatywnie, doniesiono, że katalizatory metaliczne, takie jak kobalt i miedź, katalizują termicznie zabronione cykloaddycje [2 + 2] poprzez przeniesienie pojedynczego elektronu.
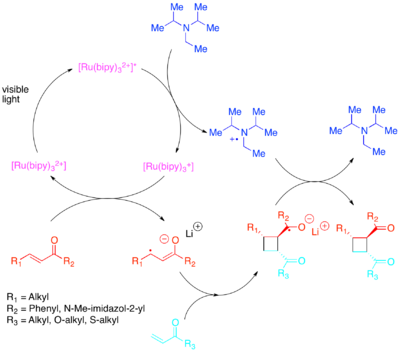
Wymaganą zmianę w populacjach orbitalnych można osiągnąć poprzez transfer elektronów za pomocą fotokatalizatora wrażliwego na światło widzialne o niższej energii. Yoon zademonstrował wydajne wewnątrz- i międzycząsteczkowe [2+2] cykloaddycje aktywowanych olefin : szczególnie enonów i styrenów. Odkryto, że enony, czyli ubogie w elektrony olefiny, reagują drogą rodnikowo-anionową, wykorzystując diizopropyloetyloaminę jako przejściowe źródło elektronów. Dla tego przeniesienia elektronu [Ru(bipy) 3 ] 2+ odkryto, że jest skutecznym fotokatalizatorem. Anionowy charakter cyklizacji okazał się kluczowy: przeprowadzenie reakcji w kwasie, a nie z przeciwjonem litu, sprzyjało szlakowi bez cykloaddycji. Zhao i in. chalkonów z przeciwjonem samarowym dostępna jest jeszcze inna ścieżka cyklizacji . Odwrotnie, stwierdzono, że styreny bogate w elektrony reagują poprzez mechanizm kationów rodnikowych, wykorzystując viologen metylowy lub tlen cząsteczkowy jako przejściowy pochłaniacz elektronów. Podczas gdy [Ru(bipy) 3 ] 2+ okazał się kompetentnym katalizatorem wewnątrzcząsteczkowych cyklizacji przy użyciu viologenu metylowego , nie mógł być stosowany z tlenem cząsteczkowym jako pochłaniacz elektronów ani do cyklizacji międzycząsteczkowych. W przypadku cyklizacji międzycząsteczkowych Yoon i in. odkryli, że silniej utleniający fotokatalizator [Ru(bpm) 3 ] 2+ i tlen cząsteczkowy zapewniają układ katalityczny lepiej przystosowany do dostępu do kationu rodnikowego niezbędnego do zajścia cykloaddycji. [Ru(bpz) 3 ] 2+ , jeszcze silniej utleniający fotokatalizator, okazał się problematyczny, ponieważ chociaż mógł katalizować pożądaną [2+2] cykloaddycję, był również wystarczająco silny, aby utlenić cykloaddukt i katalizować reakcję retro-[2+2]. To porównanie fotokatalizatorów podkreśla znaczenie dostrojenia właściwości redoks fotokatalizatora do układu reakcji, a także wykazania wartości związków polipirydylowych jako ligandów, ze względu na łatwość, z jaką można je modyfikować w celu dostosowania właściwości redoks ich kompleksów.
Katalizowane fotoredoksem [2+2] cykloaddycje można również przeprowadzić za pomocą organicznego katalizatora fotoredoks trifenylopiroliowego.
Oprócz zabronionej termicznie cykloaddycji [2+2], do cyklizacji [4+2] ( reakcja Dielsa-Aldera ) można zastosować katalizę fotoredoks . Bis-enony, podobne do substratów używanych do cyklizacji fotoredoks [2+2], ale z dłuższym łącznikiem łączącym dwie enonowe grupy funkcyjne, przechodzą wewnątrzcząsteczkowe reakcje rodnikowo-anionowe hetero-Dielsa-olchy szybciej niż [2+2] cykloaddycja.
Podobnie bogate w elektrony styreny uczestniczą w wewnątrz- lub międzycząsteczkowych cyklizacjach Dielsa-Aldera poprzez rodnikowy mechanizm kationowy. [Ru(bipy) 3 ] 2+ był kompetentnym katalizatorem międzycząsteczkowych, ale nie wewnątrzcząsteczkowych cyklizacji Dielsa-Aldera. Ta katalizowana fotoredoks reakcja Dielsa-Aldera umożliwia cykloaddycję między dwoma elektronicznie niedopasowanymi substratami. Normalne zapotrzebowanie elektroniczne na reakcję Dielsa-Aldera wymaga dienu bogatego w elektrony reagować z olefiną ubogą w elektrony (lub „dienofilem”), podczas gdy reakcja Dielsa-Aldera z odwrotnym zapotrzebowaniem na elektrony zachodzi między przeciwnym przypadkiem dienu ubogiego w elektrony i dienofila bardzo bogatego w elektrony. Przypadek fotoredoksu, ponieważ zachodzi według innego mechanizmu niż termiczna reakcja Dielsa-Aldera, umożliwia cykloaddycję między dienem bogatym w elektrony a dienofilem bogatym w elektrony, umożliwiając dostęp do nowych klas adduktów Dielsa-Aldera.
Syntetyczna wartość reakcji Dielsa-Aldera styrenu katalizowanej fotoredoksem została wykazana poprzez całkowitą syntezę produktu naturalnego Heitziamide A. Synteza ta pokazuje, że termiczna reakcja Dielsa-Aldera faworyzuje niepożądany regioizomer, ale reakcja katalizowana fotoredoksem daje pożądany regioizomer z lepszą wydajnością.
Organokataliza fotoredoksu
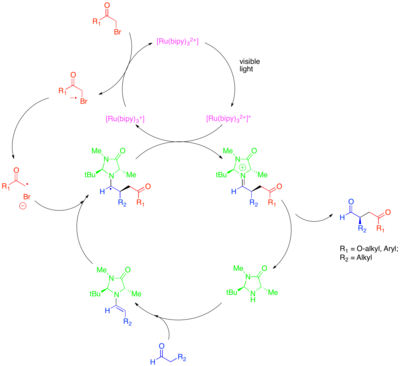
Organokataliza to poddziedzina katalizy, która bada potencjał małych cząsteczek organicznych jako katalizatorów, szczególnie do enancjoselektywnego tworzenia cząsteczek chiralnych. Jedną ze strategii w tej poddziedzinie jest użycie chiralnych amin drugorzędowych do aktywacji związków karbonylowych. W tym przypadku kondensacja aminy ze związkiem karbonylowym generuje enaminę nukleofilową . Chiralna amina jest zaprojektowana w taki sposób, że jedna strona enaminy jest ekranowana sterycznie i tylko nieekranowana strona może swobodnie reagować. Pomimo mocy tego podejścia do katalizowania enancjoselektywnej funkcjonalizacji związków karbonylowych, niektóre cenne przemiany, takie jak katalityczne enancjoselektywne α-alkilowanie aldehydów , pozostały nieuchwytne. Połączenie metod katalizy organicznej i fotoredoks zapewnia katalityczne rozwiązanie tego problemu. W tym podejściu do α-alkilowania aldehydów [Ru(bipy) 3 ] 2+ redukuje fragmentację aktywowanego halogenku alkilu, takiego jak bromomalonian lub bromek fenacylu , który może następnie dodawać do enaminy generowanej katalitycznie w sposób enancjoselektywny. Utleniony fotokatalizator następnie oksydacyjnie gasi powstały rodnik α-aminowy, tworząc jon iminiowy, który hydrolizuje, dając funkcjonalizowany związek karbonylowy. Wykazano, że ta transformacja fotoredoks różni się mechanistycznie od innego organokatalitycznego procesu rodnikowego, zwanego katalizą pojedynczo zajmowanego orbitalu molekularnego (SOMO). Kataliza SOMO wykorzystuje superstechiometryczny azotan cerowo-amonowy (CAN) w celu utlenienia enaminy wytworzonej katalitycznie do odpowiedniego kationu rodnikowego, który można następnie dodać do odpowiedniego partnera sprzęgania, takiego jak allilosilan. Ten typ mechanizmu jest wykluczony w reakcji fotokatalitycznego alkilowania, ponieważ podczas gdy zaobserwowano, że kation rodnika enaminy cyklizuje na bocznych olefinach i otwiera zegary rodników cyklopropanu w katalizie SOMO, struktury te były niereaktywne w reakcji fotoredoks.
Ta przemiana obejmuje alkilowanie innymi klasami aktywowanych halogenków alkilowych o znaczeniu syntetycznym. W szczególności zastosowanie fotokatalizatora Ir(dtbbpy)(ppy) 2 + umożliwia enancjoselektywną α-trifluorometylację aldehydów, podczas gdy zastosowanie Ir(ppy) 3 umożliwił enancjoselektywne sprzęganie aldehydów z ubogimi w elektrony bromkami benzylu. Zeitler i in. zbadali również produktywne połączenie metod fotoredoks i organokatalitycznych w celu uzyskania enancjoselektywnego alkilowania aldehydów. Ten sam chiralny organokatalizator imidazolidynonu zastosowano do wytworzenia enaminy i wprowadzenia chiralności. Jednak zamiast kompleksu rutenu lub irydu zastosowano organiczny katalizator fotoredoks, eozynę Y.
Bezpośrednie β-arylowanie nasyconych aldehydów i ketonów można przeprowadzić poprzez połączenie metod fotoredoks i organokatalitycznych. Poprzednia metoda uzyskiwania bezpośredniej β-funkcjonalizacji nasyconego karbonylu składa się z jednego naczynia składającego się z dwuetapowego procesu, oba katalizowane przez drugorzędowy katalizator aminowy: stechiometryczna redukcja aldehydu za pomocą IBX, a następnie dodanie aktywowanego nukleofilu alkilowego do pozycji beta powstałego enalu . Ta przemiana, która podobnie jak inne procesy fotoredoks odbywa się na zasadzie rodnikowego mechanizmu, ogranicza się do dodania do pozycji beta silnie elektrofilowych arenów. Poważne ograniczenia zakresu składnika arenowego w tej reakcji wynikają przede wszystkim z potrzeby anionu rodnikowego arenowego, który jest wystarczająco stabilny, aby nie reagować bezpośrednio z enaminą lub kationem rodnika enaminy. W proponowanym mechanizmie aktywowany katalizator fotoredoks jest gaszony utleniająco przez aren z niedoborem elektronów, taki jak 1,4-dicyjanobenzen . Fotokatalizator następnie utlenia rodzaj enaminy, przejściowo generowany przez kondensację aldehydu z drugorzędowym kokatalizatorem aminowym, takim jak optymalna izopropylobenzyloamina. Powstały kation rodnikowy enaminy zwykle reaguje jako układ 3-elektronowy π, ale ze względu na stabilność rodnikowych partnerów sprzęgających, deprotonowanie pozycji β-metylenowej powoduje powstanie układu 5-elektronowego π o silnym rodnikowym charakterze na nowo uzyskanym β-węglu. Chociaż reakcja ta opiera się na zastosowaniu organokatalizatora amin drugorzędowych do wytworzenia form enaminy, które są utleniane w proponowanym mechanizmie, nie istnieje żaden enancjoselektywny wariant tej reakcji.
Rozwój tego bezpośredniego β-arylowania aldehydów doprowadził do powiązanych reakcji β-funkcjonalizacji cyklicznych ketonów. W szczególności β-arylowanie cyklicznych ketonów osiągnięto w podobnych warunkach reakcji, ale stosując azepan jako drugorzędowy kokatalizator aminowy. Fotokatalityczna reakcja „homo-aldolowa” działa w przypadku cyklicznych ketonów, umożliwiając sprzężenie pozycji beta ketonu z węglem ipso ketonów arylowych, takich jak benzofenon i acetofenon . Oprócz kokatalizatora azepanowego reakcja ta wymaga użycia silniej redukującego katalizatora fotoredoks Ir(ppy) 3 i dodanie heksafluoroarseniku litu (LiAsF6 ) w celu promowania jednoelektronowej redukcji ketonu arylowego.
Dodatki do olefin
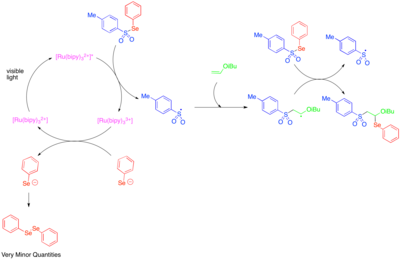
Zastosowanie katalizy fotoredoks do generowania reaktywnych rodników skupionych na heteroatomach zostało po raz pierwszy zbadane w latach 90. Stwierdzono , że [Ru(bipy) 3 ] 2+ katalizuje fragmentację tosylofenyloselenolanu do anionu fenyloselenolanowego i rodnika tosylowego, a mechanizm propagacji łańcucha rodnikowego umożliwia dodanie rodnika tosylowego i rodnika fenyloseleno- w poprzek podwójnego wiązania bogatych w elektrony eterów alkilowo-winylowych. Ponieważ anion fenyloselenolanu jest łatwo utleniany do difenylodiselenku, obserwowane małe ilości difenylodiselenku przyjęto jako wskazówkę, że fragmentacja tosylofenyloselenokatalizowana przez fotoredoks była ważna tylko jako etap inicjacji i że większość reaktywności wynikała z rodnikowego procesu łańcuchowego.
Heteroaromatyczne dodatki do olefin obejmują wieloskładnikowe reakcje oksy- i aminotrifluorometylacji. Reakcje te wykorzystują odczynnik Umemoto, sól sulfoniową, która służy jako elektrofilowe źródło grupy trifluorometylowej i która poprzedza reakcję poprzez szlak przenoszenia pojedynczego elektronu. Zatem redukcja pojedynczego elektronu odczynnika Umemoto uwalnia rodnik trifluorometylowy, który dodaje się do reaktywnej olefiny. Następnie jednoelektronowe utlenianie rodnika alkilowego generowanego przez to dodanie prowadzi do powstania kationu, który może zostać uwięziony przez wodę, alkohol lub nitryl. Aby osiągnąć wysoki poziom regioselektywności, zbadano tę reaktywność głównie dla styrenów, które są ukierunkowane na tworzenie pośredniego rodnika benzylowego.
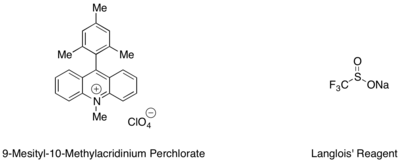
Hydrotrifluorometylację styrenów i alkenów alifatycznych można przeprowadzić za pomocą mezytyloakrydynowego organicznego katalizatora fotoredoks i odczynnika Langloisa jako źródła rodnika CF3 . W tej reakcji stwierdzono, że trifluoroetanol i substechiometryczne ilości aromatycznego tiolu, takiego jak tiosalicylan metylu, stosowane w tandemie, służyły jako najlepsze źródło rodnika wodorowego do zakończenia cyklu katalitycznego.
Wewnątrzcząsteczkowe hydroeteryfikacje i hydroaminacje przebiegają z selektywnością antymarkownikowską. Jeden mechanizm wywołuje utlenianie olefiny przez pojedynczy elektron, wychwytywanie kationu rodnikowego przez dołączoną hydroksylową lub aminową grupę funkcyjną i wygaszanie powstałego rodnika alkilowego przez przeniesienie atomu H z wysoce nietrwałych gatunków donorowych. Rozszerzenie tej reaktywności na układy międzycząsteczkowe zaowocowało i) nową drogą syntezy złożonych tetrahydrofuranów przez „cykloaddycję polarno-rodnikową z krzyżowaniem” (reakcja PRCC) alkoholu allilowego z olefiną oraz ii) dodatek anty-Markovnikov kwasów karboksylowych do olefin.


![\left({\frac {I_{0}}{I}}\right)=1+{k_{q}}*{\tau _{0}}\times [Q]](https://wikimedia.org/api/rest_v1/media/math/render/svg/338eb04d84052783d691791ccf5c329070594aa0)