Kompleks perydynina-chlorofil-białko
| Perydynina-chlorofil Białko wiążące | |||||||||
|---|---|---|---|---|---|---|---|---|---|
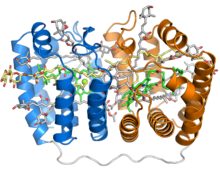
Struktura krystaliczna rozpuszczalnego kompleksu perydynina-chlorofil-białko z fotosyntetycznego bruzdnic Amphidinium carterae . Kompleks ten występuje w wielu fotosyntetycznych bruzdnicach i obejmuje białko w kształcie łódki lub kołyski z dwoma pseudosymetrycznymi powtórzeniami ośmiu helis alfa (pokazanych na niebiesko i pomarańczowo) owiniętych wokół wypełnionej pigmentem centralnej jamy. Każdy segment z ośmioma helisami wiąże jedną cząsteczkę chlorofilu (zielona, z centralnym jonem magnezu pokazanym jako zielona kula), jedną cząsteczkę diacyloglicerolu (żółta) i cztery cząsteczki perydyniny (szare).
| |||||||||
| Identyfikatory | |||||||||
| Symbol | PCP | ||||||||
| Pfam | PF02429 | ||||||||
| InterPro | IPR003376 | ||||||||
| SCOP2 | 1ppr / ZAKRES / SUPFAM | ||||||||
| |||||||||
perydynina- chlorofil- białko ( PCP lub PerCP ) jest rozpuszczalnym kompleksem molekularnym składającym się z perydyniny- chlorofilu a-białka związanego z perydyniną , chlorofilem i lipidami . Cząsteczki perydyniny pochłaniają światło o długości fali niebiesko-zielonej (470 do 550 nm) i przekazują energię cząsteczkom chlorofilu z niezwykle wysoką wydajnością. Kompleksy PCP znajdują się w wielu fotosyntetycznych bruzdnicach , w których mogą być głównymi kompleksami zbierającymi światło .
Struktura

Białko PCP zidentyfikowano w genomach bruzdnic w co najmniej dwóch postaciach, postaci homodimerycznej złożonej z dwóch monomerów o masie cząsteczkowej 15 kD i postaci monomerycznej o masie około 32 kD, co do której uważa się, że wyewoluowała z postaci homodimerycznej poprzez duplikację genu . Forma monomeryczna składa się z dwóch pseudosymetrycznych domen z ośmioma helisami , w których helisy są upakowane w złożonej topologii przypominającej arkusze beta w fałdzie galaretki . Trójwymiarowy układ helis tworzy cząsteczkę w kształcie łódki z dużą centralną wnęką, w której związane są pigmenty i lipidy. Każdy segment z ośmioma helisami zazwyczaj wiąże cztery perydyniny , jedną cząsteczkę chlorofilu i jedną cząsteczkę lipidu , taką jak digalaktozylodiacylogliceryna ; jednak ta stechiometria różni się w zależności od gatunku i izoform PCP . Najpowszechniejszy stosunek perydyniny do chlorofilu 4:1 został przewidziany na podstawie spektroskopii w latach 70. struktura krystaliczna kompleksu Amphidinium carterae PCP została rozwiązana w latach 90. Niezależnie od tego, czy powstaje z monomeru, czy dimeru białka, złożony kompleks białko-pigment jest czasami nazywany bPCP (od „bloku budulcowego”) i jest minimalną stabilną jednostką. Przynajmniej w niektórych formach PCP, w tym z A. carterae , te bloki budulcowe składają się w trimer uważany za biologicznie funkcjonalny stan.
Kiedy struktura krystalografii rentgenowskiej PCP została rozwiązana w 1997 r., Reprezentowała ona nowy fałd białkowy , a jego topologia pozostaje wyjątkowa wśród znanych białek. Struktura jest określana przez bazę danych CATH , która systematycznie klasyfikuje struktury białek, jako fałd „alfa solenoidu”; jednak w innych miejscach w literaturze termin alfa solenoid jest używany w odniesieniu do otwartych i mniej zwartych helikalnych struktur białkowych.
Funkcjonować
Fotosyntetyczne bruzdnice zawierają związane z błoną kompleksy zbierające światło, podobne do tych występujących w zielonych roślinach . Dodatkowo zawierają rozpuszczalne w wodzie kompleksy białkowo-pigmentowe, które wykorzystują karotenoidy , takie jak perydynina aby przedłużyć ich zdolność fotosyntezy. Perydynina pochłania światło o długości fal niebiesko-zielonych (470 do 550 nm), które są niedostępne dla samego chlorofilu; zamiast tego kompleks PCP wykorzystuje geometrię względnych orientacji pigmentu, aby uzyskać niezwykle wydajny transfer energii z cząsteczek perydyniny do sąsiedniej cząsteczki chlorofilu. PCP służył jako wspólny system modelowy do spektroskopii i obliczeń teoretycznych związanych z fotofizyką białek.
Uważa się, że kompleksy PCP zajmują światło tylakoidów . Uważa się, że po przeniesieniu energii z perydyniny do pigmentu chlorofilowego, kompleksy PCP przenoszą następnie energię ze wzbudzonego chlorofilu do kompleksów zbierających światło związanych z błoną .
