Kwadratowa płaska geometria molekularna
| Kwadratowa płaska geometria molekularna | |
|---|---|
 | |
| Przykłady |
XeF 4 , PtCl 2− 4 |
| Grupa punktowa | D 4 godz |
| Numer koordynacyjny | 4 |
| Kąt (y) wiązania | 90° |
| μ (biegunowość) | 0 |

Kwadratowa płaska geometria molekularna w chemii opisuje stereochemię (przestrzenne rozmieszczenie atomów), którą przyjmują niektóre związki chemiczne . Jak sama nazwa wskazuje, cząsteczki o tej geometrii mają swoje atomy ustawione w rogach.
Przykłady
Liczne związki przyjmują tę geometrię, a przykłady są szczególnie liczne w przypadku kompleksów metali przejściowych. Związek gazu szlachetnego XeF 4 przyjmuje tę strukturę zgodnie z przewidywaniami teorii VSEPR . Geometria jest dominująca dla kompleksów metali przejściowych o konfiguracji d8 , która obejmuje Rh(I), Ir(I), Pd(II), Pt(II) i Au(III). Godne uwagi przykłady obejmują leki przeciwnowotworowe, cisplatynę [PtCl 2 (NH 3 ) 2 ] i karboplatynę . Wiele katalizatorów jednorodnych ma kwadratową płaszczyznę w stanie spoczynku, na przykład katalizator Wilkinsona i katalizator Crabtree'a . Inne przykłady obejmują kompleks Vaski i sól Zeise'a . Pewne ligandy (takie jak porfiryny ) stabilizują tę geometrię.
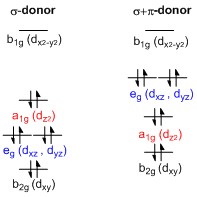
Podział d-orbitali
Ogólny diagram rozszczepienia d-orbitalnego dla kompleksów metali przejściowych o kwadratowej powierzchni (D 4h ) można wyprowadzić z ogólnego diagramu rozszczepienia oktaedrycznego (O h ) , na którym orbitale dz 2 i d x 2 − y 2 są zdegenerowane i wyższe energii niż zdegenerowany zbiór orbitali d xy , d xz i dyz . Kiedy dwa osiowe ligandy zostaną usunięte w celu wygenerowania kwadratowej płaskiej geometrii, dz 2 orbital jest napędzany niższą energią, ponieważ odpychanie elektron-elektron z ligandami na osi z nie jest już obecne. Jednak dla ligandów przekazujących wyłącznie σ orbital dz 2 ma wciąż wyższą energię niż orbitale dxy kształcie , dxz i dyz z powodu płata orbitalu dz 2 w torusa . Nosi gęstość elektronów na osiach x i y, a zatem oddziałuje z wypełnionymi orbitalami liganda. d xy , d xz i d yz orbitale są generalnie przedstawiane jako zdegenerowane, ale muszą się rozszczepić na dwa różne poziomy energetyczne w odniesieniu do nieredukowalnych reprezentacji grupy punktowej D 4h . Ich względna kolejność zależy od charakteru konkretnego kompleksu. Ponadto rozszczepienie orbitali d jest zakłócane przez ligandy dostarczające π, w przeciwieństwie do kompleksów oktaedrycznych . W kwadratowym przypadku planarnym ligandy silnie dostarczające π mogą powodować, że orbitale d xz i dyz mają wyższą energię niż dz 2 orbital, podczas gdy w przypadku oktaedrycznym ligandy dostarczające π wpływają tylko na wielkość rozszczepienia d-orbitalu, a względna kolejność orbitali jest zachowana.
Zobacz też
Linki zewnętrzne
- 3D Chem – chemia, struktury i cząsteczki 3D
- IUMSC – Centrum Struktur Molekularnych Uniwersytetu Indiany
- Interaktywne przykłady molekularne dla grup punktowych
- [1] – Liczby koordynacyjne i jony złożone