Geometria molekularna w kształcie litery T
| Geometria molekularna w kształcie litery T | |
|---|---|
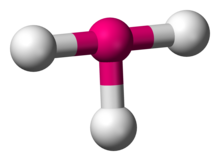 | |
| Przykłady | ClF 3 |
| Grupa punktowa | C 2v |
| Numer koordynacyjny | 3 |
| Kąt (y) wiązania | 90°, 180° |
| μ (biegunowość) | >0 |

W chemii geometria molekularna w kształcie litery T opisuje struktury niektórych cząsteczek, w których centralny atom ma trzy ligandy . Zwykle trójskoordynowane związki przyjmują geometrię trygonalną płaską lub piramidalną . Przykładami cząsteczek w CIF3 kształcie litery T są trifluorki fluorowców, takie jak .
Zgodnie z teorią VSEPR , geometria w kształcie litery T powstaje, gdy trzy ligandy i dwie wolne pary elektronów są związane z atomem centralnym, zapisanym w notacji AX jako AX 3 E 2 . Geometria w kształcie litery T jest powiązana z trygonalną bipiramidalną geometrią molekularną dla cząsteczek AX 5 z trzema ligandami równikowymi i dwoma osiowymi. W AX 3 E 2 cząsteczka, dwie samotne pary zajmują dwie pozycje równikowe, a trzy atomy liganda zajmują dwie pozycje osiowe, jak również jedną pozycję równikową. Trzy atomy łączą się pod kątem 90° po jednej stronie atomu centralnego, tworząc kształt litery T.
Anion trifluoroksenianu(II), XeF
− 3 , został zbadany jako możliwy pierwszy przykład cząsteczki AX 3 E 3 , od której można by oczekiwać na podstawie rozumowania VSEPR, że ma sześć par elektronów w układzie oktaedrycznym z trzema samotnymi parami i trzy ligandy w orientacji meru lub w kształcie litery T. Chociaż anion ten został wykryty w fazie gazowej, próby syntezy w roztworze i eksperymentalne określenie struktury zakończyły się niepowodzeniem. Chemia obliczeniowa badanie wykazało zniekształconą płaską geometrię w kształcie litery Y z najmniejszym kątem wiązania F – Xe – F równym 69 °, a nie 90 °, jak w geometrii w kształcie litery T.
Zobacz też
- Bibliografia _ Earnshaw, A. (1997). Chemia pierwiastków (wyd. 2). Oksford: Butterworth-Heinemann. ISBN 978-0-7506-3365-9 .
- Bibliografia _ Sharpe, AG (2004). Chemia nieorganiczna (wyd. 2). Sala Prentice'a. P. 47. ISBN 978-0-13-039913-7 .
-
^ ab Vasdev
, Neil ; Moran, Matthew D.; Tuononen, Heikki M.; Chirakal, Raman; Suontamo, Reijo J.; Bain, Alex D.; Schrobilgen, Gary J. (2010). „Dowody spektroskopowe NMR na pośrednictwo XeF
- 3 w XeF 2 / F - Wymiana, próby syntezy i termochemia soli XeF
- 3 oraz teoretyczne badania anionu XeF
- 3 ” . Inorg. chemia 49 (19): 8997–9004. doi : 10,1021/ic101275m . PMID 20799721 .
Linki zewnętrzne
- chemia| Chemia, struktury i cząsteczki 3D [ stały martwy link ]
- Centrum Struktury Molekularnej Uniwersytetu Indiany
- Interaktywne przykłady molekularne dla grup punktowych
- Modelowanie molekularne
- Animowana grafika trygonalna płaska