Huśtawka geometrii molekularnej
| Huśtawka geometrii molekularnej | |
|---|---|
 | |
| Przykłady | SF 4 |
| Grupa punktowa | C 2v |
| Numer koordynacyjny | 4 |
| Kąt (y) wiązania |
Idealny ax-ax 180°, eq-eq 120°, ax-eq 90° SF 4 ax-ax 173,1°, eq-eq 101,6° |
| μ (biegunowość) | >0 |
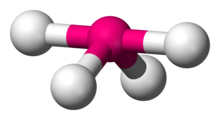
Disphenoidal lub huśtawka (znana również jako konik piły) to rodzaj geometrii molekularnej , w której istnieją cztery wiązania z centralnym atomem z ogólną symetrią cząsteczkową C2v . Nazwa „huśtawka” wzięła się z obserwacji, że wygląda jak huśtawka na placu zabaw . Najczęściej cztery wiązania z centralnym atomem skutkują tetraedryczną lub rzadziej kwadratową płaską geometrią .
Geometria huśtawki występuje, gdy cząsteczka ma liczbę steryczną 5, przy czym centralny atom jest związany z 4 innymi atomami i 1 samotną parą (AX 4 E 1 w notacji AX ). Atom związany z 5 innymi atomami (bez samotnych par) tworzy bipiramidę trygonalną z dwoma położeniami osiowymi i trzema równikowymi, ale w geometrii huśtawki jeden z atomów jest zastąpiony samotną parą elektronów, która zawsze znajduje się w położeniu równikowym. Jest to prawdą, ponieważ samotna para zajmuje więcej miejsca w pobliżu atomu centralnego (A) niż wiążąca para elektronów. Równikowa samotna para jest odpychana tylko przez dwie pary wiążące pod kątem 90 °, podczas gdy hipotetyczna samotna para osiowa byłaby odpychana przez trzy pary wiążące pod kątem 90 °, co zapewniłoby jej stabilność. Odpychanie przez wiązanie par pod kątem 120 ° jest znacznie mniejsze i mniej ważne.
Struktura
Związki o geometrii dysfenoidalnej (geometria See-Saw) mają dwa rodzaje ligandów : osiowe i równikowe. Para osiowa leży wzdłuż wspólnej osi wiązania, tak że są powiązane kątem wiązania 180°. Para równikowa ligandów leży w płaszczyźnie prostopadłej do osi pary osiowej. Zazwyczaj odległość wiązania do ligandów osiowych jest większa niż do ligandów równikowych. Idealny kąt między ligandami osiowymi a ligandami równikowymi wynosi 90 °; podczas gdy idealny kąt między dwoma ligandami równikowymi wynosi 120 °.
Cząsteczki dysfenoidalne, takie jak trygonalne bipiramidalne, podlegają pseudorotacji Berry'ego , w której ligandy osiowe przesuwają się do pozycji równikowych i odwrotnie. Ta wymiana pozycji skutkuje podobnymi uśrednionymi w czasie środowiskami dla dwóch typów ligandów. Tak więc widmo 19F NMR SF4 ) (podobnie jak widmo PF5 składa się z pojedynczego rezonansu bliskiego temperaturze pokojowej. Cztery atomy w ruchu działają jak dźwignia wokół centralnego atomu; na przykład cztery atomy fluoru tetrafluorku siarki obracają się wokół atomu siarki.
Przykłady
Czterofluorek siarki jest najlepszym przykładem cząsteczki o geometrii cząsteczkowej disfenoidalnej (patrz zdjęcie w prawym górnym rogu). Następujące związki i jony mają geometrię dysfenoidalną:
Zobacz też
Linki zewnętrzne
- chemia| Chemia, struktury i cząsteczki 3D [ stały martwy link ]
- Centrum Struktur Molekularnych Uniwersytetu Indiany
- Interaktywne przykłady molekularne dla grup punktowych
- Modelowanie molekularne
- Animowana grafika trygonalna płaska
- VSEPR