Ligand czterokleszczowy
W chemii ligandy czterokleszczowe to ligandy , które wiążą cztery atomy donorowe z atomem centralnym, tworząc kompleks koordynacyjny . Ta liczba atomów donorowych, które się wiążą, nazywana jest dentycznością i jest metodą klasyfikacji ligandów.
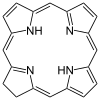
Ligandy czterokleszczowe występują powszechnie w przyrodzie w postaci chlorofilu , który ma ligand rdzenia zwany chloryną , oraz hemu , który ma ligand rdzenia zwany porfiryną . Odpowiadają za barwę obserwowaną u roślin i ludzi. Ftalocyjanina jest sztucznym makrocyklicznym czterokleszczowym ligandem, który jest używany do wytwarzania niebieskich i zielonych pigmentów.
Kształt
Ligandy czterokleszczowe można klasyfikować według topologii połączeń między atomami donorowymi. Typowe formy to liniowe (zwane także sekwencyjnymi), pierścieniowe lub trójnożne . Ligand tetrapodalny, który jest również czterokleszczowy, ma cztery nogi z atomami dawcy i przyczółek, który nie jest dawcą. Po związaniu z centralnym atomem istnieje kilka możliwych układów (znanych jako izomery geometryczne).
Ligandy liniowe
Liniowy czterokleszczowy ligand ma cztery atomy donorowe w jednej linii, a każdy kolejny donor jest połączony jednym z trzech mostków. Taki ligand związany z metalem w czworościennej koordynacji może łączyć się tylko w jeden sposób, chociaż jeśli ligand jest niesymetryczny, to istnieją dwa układy chiralne . Liniowy czterokleszczowy ligand może również wiązać się z metalem w kwadratowej płaskiej koordynacji w jeden sposób, gdzie układy przeciwnie do ruchu wskazówek zegara lub zgodnie z ruchem wskazówek zegara są równoważne.
Ligandy liniowe w koordynacji oktaedrycznej
Liniowy czterokleszczowy ligand ma swoje atomy donorowe rozmieszczone wzdłuż lub w łańcuchu tak, że każdy sąsiedni atom donorowy musi sąsiadować z atomem centralnym. Taki układ prowadzi do trzech wyników stereochemicznych, a cztery grupy dawców mogą być współrównikowe. Ta geometria nazywana jest trans , ponieważ pozostałe niezajęte pozycje na ośmiościanie są wzajemnie trans (przeciwne). Gdy dwa wewnętrzne atomy donorowe są piramidalne (takie jak drugorzędowe aminy w trien lub EDDA ), dwa diastereoizomery dla układu trans są określone przez względną stereochemię tych centrów. Zazwyczaj donory te są wzajemnie trans, co daje chiralny kompleks C2 - symetrycznych kompleksów . Układ ten ilustrują kompleksy ligandu Trosta .
Ligand może się wygiąć tak, że jeden atom donorowy znajduje się na biegunie, a pozostałe trzy na równiku atomu centralnego. Nazywa się to cis -β (beta). Pozostałe pozycje oktaedryczne są cis (sąsiadujące) ze sobą. Trójkąty atomów koordynujących i atom centralny mają dwa atomy współpłaszczyznowe i jeden atom prostopadły. Ten układ jest chiralny, więc możliwe są dwa odbicia lustrzane. Układ, w którym łańcuch idzie w dół i zgodnie z ruchem wskazówek zegara, nazywa się lambda, Λ, a gdzie biegnie w dół i w kierunku przeciwnym do ruchu wskazówek zegara, nazywa się delta, Δ. Jeśli łańcuch nie jest symetryczny, na końcu ligandu, który ma zagięcie, mogą powstawać różne izomery. Jeśli trzy atomy donorowe są takie same na jednym końcu łańcucha, można stosować przedrostki mer - i fac - stosowane dla ligandów trójkleszczowych. Jeśli trzy atomy donorowe są ułożone na południku, używany jest β- mer ; jeśli trzy atomy donorowe są ułożone na powierzchni ośmiościanu, stosuje się β- fac .
Łańcuch może mieć dwa zagięcia, z jednym donorem na biegunie, dwoma na równiku i jednym na przeciwległym biegunie. Żaden z trójkątów koordynujących atomów i atomu centralnego nie jest współpłaszczyznowy. Nazywa się to cis -alfa (α). Ten układ jest chiralny, więc możliwe są dwa odbicia lustrzane. Układ, w którym łańcuch biegnie w dół, zgodnie z ruchem wskazówek zegara i w dół, nazywa się lambda, Λ, a gdzie biegnie w dół, w kierunku przeciwnym do ruchu wskazówek zegara i w dół, nazywa się delta (Δ).
Ligandy trójnożne
Tripodalne ligandy czterokleszczowe mają atom donorowy połączony trzema łańcuchami z innymi atomami donorowymi. Wierzchołek statywu nazywany jest wierzchołkiem, a atom donorowy w tej pozycji jest wierzchołkiem lub znanym również jako atom mostkowy. Pozostałe trzy atomy dawcy znajdują się na „stopach” statywu. Tripodalne czterokleszczowe ligandy mogą mieć trzy identyczne łańcuchy przyłączone do atomu (takiego jak azot, fosfor lub arsen) w układzie trzeciorzędowym. Cząsteczki zawierające atomy donorowe fosforu lub arsenu pozostają sztywne w P lub As i mogą zachować swój kształt, w przeciwieństwie do związków azotu, które szybko racemizują . Jeśli wszystkie stopy statywu są symetryczne i identyczne względem siebie, będzie tylko jeden sposób mocowania w koordynacji oktaedrycznej. Jednak na atomie centralnym pozostały dwie nierównoważne pozycje, więc jeśli przyłączą się dwa różne ligandy jednokleszczowe lub niesymetryczny ligand dwukleszczowy, będą dwa możliwe izomery. Jeśli stopy różnią się, jest więcej izomerów. Kiedy dwie stopy są takie same, a jedna jest inna, istnieją trzy układy, z których dwa są wzajemnymi enancjomerami. Gdy istnieją trzy różne nogi, istnieje sześć możliwych izomerów, ale dwa są enancjomerami innej pary, a dwa są symetryczne.
Atomy z pięcioma pozycjami współrzędnych mają zwykle geometrię trygonalnej bipiramidy lub piramidy kwadratowej . Symetryczny tripodalny tetrakleszczowy ligand może tworzyć dwa izomery na kwadratowej piramidzie, w zależności od tego, czy dawca pomostowy znajduje się na wierzchołku, czy na podstawie piramidy. Dodatkowe wolne miejsce na piramidzie kwadratowej znajduje się na podstawie. Kwadratowa koordynacja piramidalna występuje zwykle tam, gdzie tworzy się sześcioczłonowy pierścień z przyczółkiem, mostkiem, atomem dawcy stóp i atomem centralnym. Dłuższa noga (z trzema mostkowymi atomami) łączy się z wierzchołkiem piramidy i symetria zostaje utracona.
W przypadku bipiramidy trygonalnej ligand w kształcie trójnogu ma najbardziej symetryczną pozycję z donorem mostkującym na jednym z wierzchołków, a stopy statywu są rozmieszczone wokół podstawy, pozostawiając wolne miejsce na przeciwległym wierzchołku, co skutkuje C 3 v symetria. Trygonalna koordynacja bipiramidalna zwykle występuje tam, gdzie tworzy się pięcioczłonowe pierścienie z przyczółkiem, mostkiem, atomami dawcy stóp i atomem centralnym.
W czterech koordynacjach trójnożny ligand wypełniłby wszystkie dostępne pozycje, geometria to piramida trygonalna . Kształt jest zniekształcony w stosunku do czworościanu z powodu braku symetrii statywu.
Klasyfikacja
Oprócz kształtu, ligandy czterokleszczowe można klasyfikować według atomów ligujących na ligandzie. W przypadku ligandów liniowych można podać kolejność. Ligand może mieć ładunek ujemny, gdy jest w kompleksie z centralnym atomem. Może to nastąpić w wyniku utraty jonów wodorowych podczas rozpuszczania substancji.
Kolejną cechą charakterystyczną jest rozmiar pierścieni utworzonych przez centralny metal z dwoma atomami donorowymi i pośrednim łańcuchem ligandu. Zwykle pierścienie te mają pięć lub sześć członów, ale czasami siedem atomów. W przypadku ligandów w kształcie pierścienia ważna jest całkowita liczba atomów w pierścieniu, ponieważ jest to wyznacznik wielkości otworu dla atomu centralnego. Każdy dodatkowy atom w pierścieniu zwiększa promień otworu od 0,1 do 0,15 Å.
Ligandy charakteryzują się również ładunkiem. Ligandy czterokleszczowe mogą być obojętne, tak że ładunek całego kompleksu jest taki sam jak ładunek centralnego atomu. Ligand czterokleszczowy monoanionowy (TMDA) ma jeden atom donora o ładunku ujemnym. Tetrakleszczowy ligand dianionowy ma podwójny ładunek ujemny, a czterokleszczowe ligandy trianionowe mają potrójny ładunek ujemny. Maksymalny ładunek występuje na czterokleszczowych ligandach tetraanionowych, które mogą stabilizować metale na wysokich stopniach utlenienia, jednak takie ligandy muszą również być odporne na utlenianie przez silnie utleniające centrum metalu.
Lista
| nazwa | skrót | formuła | kształt | typ | opłata | MW | atomy centralne | fotka |
|---|---|---|---|---|---|---|---|---|
| Chlor | pierścień | NNNN | –2 | 312.3678 | Mg |
|
||
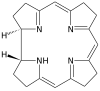
| Corrin | pierścień | NNNN | –1 | 306,40 | Współ |
|
||
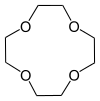
| 1,4,7,10-tetraoksacyklododekan | 12 koron-4 | ( C2H4O ) 4 _ _ | pierścień | OOOO | 0 | 176,21 | Li |
|
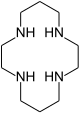
| 1,4,8,11-tetraazacyklotetradekan | cyklam | ( NHCH2CH2NHCH2CH2CH2 ) 2 _ _ _ _ _ _ _ _ | pierścień | NNNN | 200,33 | metale przejściowe |
|
|
| 1,4,7,10-tetraazacyklododekan | cykliczny | pierścień | N 4 | 172.271 | zn |

|
||
| Dibenzotetrametylotetraaza[14]annulen | tmtaa | pierścień | NNNN | 2- | UO 2 | |||
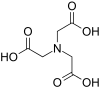
| Kwas N,N-etylenodiaminodioctowy | NH2C2H4N ( CH2COOH ) 2 _ _ _ _ _ | trójnożny | NNO 2 | 2– | ||||
| Kwas N,N'-etylenodiaminodioctowy | ( -CH2NHCH2COOH ) 2 _ _ | liniowy | NA NIE | 2– | ||||
| Kwas N-hydroksyimino-2,2'-dipropionowy | H3 HIDPA _ | HON(CH( CH3 ) CO2H ) 2 | liniowy | ONOO | 3– | V 4+ |

|
|
| kwas dietylenotriaminooctowy | DTMA | NH2C2H4NHC2H4NHCH2COOH _ _ _ _ _ _ _ _ _ _ _ _ | liniowy | NIE | 1– | Współ | ||
| kwas izodietylenotriaminooctowy | i -DTMA | ( NH2C2H4 ) 2NCH2COOH _ _ _ _ _ _ _ | trójnożny | N N 2 NIE | 1– | Współ | ||
| Ligand Jägera N2O2 | akacja liniowa | ONNO N 2 O 2 | Ni | |||||
| Naftalocyjanina | C 48 H 26 N 8 | pierścień | NNNN | 714,79 |

|
|||
| Kwas nitrylotrioctowy | NTA | N ( CH2CO2H ) 3 _ | trójnożny | NIE 3 | 3– | 191.14 | Ca 2+ , Cr, Cu 2+ i Fe 3+ , Ni |
|
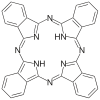
| Ftalocyjanina | H 2 szt | C 32 H 18 N 8 | pierścień | NNNN | 2– | Cu, Co |
|
|
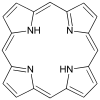
| Porfiryna | pierścień | NNNN | Mg, V, Fe, Ni |
|
||||
| Kwas rodotorulowy | C14H24N4O6 _ _ _ _ _ _ _ | kształtuję | OOOO | 344,36 | Fe 3+ |

|
||
| Salen ligand | liniowy | ONNO N 2 O 2 | 268,31 |
|
||||
| ligand salpn | salpn | liniowy | NA NIE | 2- | 282,34 | Cr, Cu, Fe, Ni |

|
|
| tetary (izomery mezo i racemiczne) | [(CH 3 ) 2 As (CH2) 3 As (C 6 H 5 ) CH 2 ] 2 | liniowy | AsAsAsAs | 0 | Co 2+ | |||
|
1,1,4,7,10,10-heksafenylo-1,4,7,10-tetrafosfadekan tetrafos |
tet-1 | liniowy | PPPP | 0 | 670,68 | Fe + Ru + Os + Re 3+ Pd 2+ Pt 2+ | ||
| 1,4,7,10-tetratiadodekan | [12]-an-S 4 | pierścień | SSSS | 0 | Cu 2+ | |||
| 1,4,7,10-tetratiatridekan | [13]-ane-S 4 | pierścień | SSSS | 0 | Cu 2+ | |||
| 1,4,8,11-tetratiatetradekan | [14]-an-S 4 | pierścień | SSSS | 0 | Cu 2+ | |||
| 1,4,8,12-tetratiapentadekan | [15]-an-S 4 | pierścień | SSSS | 0 | Cu 2+ | |||
| 1,5,9,13-tetratiaheksadekan | [14]-an-S 4 | pierścień | SSSS | 0 | Cu 2+ | |||
| 2,5,8-tritia[9](2,5)tiofenofan | pierścień | SSSS | 0 | Cu 2+ | ||||
| Eter dimetylowy glikolu trietylenowego | TG3 | CH 3 (OCH 2 CH 2 ) 3 OCH 3 | liniowy | OOOO | 0 | 178,23 | neutralny Na, K |
|
| trietylenotetramina |
TETA trien |
[ CH2NHCH2CH2NH2 ] 2 _ _ _ _ _ _ | liniowy | NNNN | 146,24 | Cu 2+ |
|
|
| tris- (dimetyloarsinopropylo)-arsyna | As [CH 2 CH 2 CH 2 As (CH 3 ) 2 ] 3 | statyw | Jak Jak 3 | 0 |
Fe 2+ Ni 2+ Co 3+ okt Ni 3+ łyżka stołowa |
|||
| tris- ( o -dimetyloarsinofenylo)-arsyna | As [ o - C6H4As ( CH3 ) 2 ] 3 _ | statyw | Jak Jak 3 | 0 |
Pt 2+ Pd 2+ Ni 2+ tbp Ru 2+ okt |
|||
| tris- ( o -difenyloarsinofenylo)-arsyna | As [ o -C 6 H 4 As (C 6 H 5 ) 2 ] 3 | statyw | Jak Jak 3 | 0 |
0 Pt 2+ Pd 2+ Ru Rh + Ni 2+ łyżka Re 2+ Ru 2+ Os 2+ Rh 3+ Pd 4+ Pt 4+ oct |
|||
| CH 3 [As(CH 3 ) o- C 6 H 4 ] 3 AsCH( 3 ) 2 | liniowy | jako 4 | 0 | Piramida kwadratowa Pd 2+ | ||||
| [As(C 6 H 5 ) 2 o- C 6 H 4 As (C 6 H 5 ) CH 2 ] 2 | liniowy | jako 4 | 0 |
Ni 2+ 4 współrzędne Ni 2+ Co 2+ pięć współrzędnych |
||||
| tris- ( o -difenylofosfinofenylo)-fosfina | trójnożna tetrafosfina Venanziego | P [ o -C 6 H 4 P (C 6 H 5 ) 2 ] 3 | statyw | PP 3 | 0 |
00 Pd 2+ Pt 2+ Ru Ru 2+ Os 2+ Cr Cr + Cr 3+ Mn + Co 3+ oct Ni 2+ Fe 2+ Co + Co 2+ tbp |
||
| Tris(2-pirydylometylo)amina | TPA | trójnożny | NN 3 | 290,37 | Cu |

|
||
| 2,2′-bi-1,10-fenantrolina | BIFEN | liniowy | N 4 | 0 | Cd Sm Am | |||
| kwaterpirydyna | qtpy | liniowy | N 4 | 0 |

|
Biomolekuły
Hem jest czterokleszczowym ligandem w kształcie heterocyklicznego pierścienia makrocyklicznego . Jest ważną cząsteczką w krwinkach czerwonych .
Chlorofil występuje w kilku formach i jest ważny w fotosyntezie roślin. Bakterie mogą wykorzystywać warianty zwane bakteriochlorofilami .
