Nadrodzina podziału komórek oporowo-guzkowatych
| Nadrodzina permeaz RND | |
|---|---|

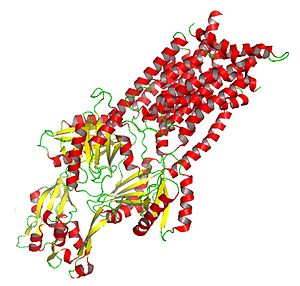
Krystalizowany AcrB : białko podklasy HAE-RND zaangażowane w
| |
| identyfikatory wypływu leków i amfifilów | |
| Symbol | RND_Przenikanie |
| Klan Pfamów | CL0322 |
| TCDB | 2.A.6 |
| Nadrodzina OPM | 16 |
| Białko OPM | 2gif |
oporności-nodulacji ( RND ) to kategoria bakteryjnych pomp wypływu , szczególnie identyfikowanych u bakterii Gram-ujemnych i zlokalizowanych w błonie cytoplazmatycznej, które aktywnie transportują substraty. Nadrodzina RND obejmuje siedem rodzin: wypływ metali ciężkich (HME), wypływ hydrofobowy /amfifilowy-1 (bakterie Gram-ujemne), rodzina eksporterów czynników nodulacyjnych (NFE), rodzina białek pomocniczych wydzielających białka SecDF, hydrofobowa/ rodzina amfifilów efflux-2, eukariotyczna homeostazy sterolowej i rodzina hydrofobowo-amfifilowa-3. Te systemy RND biorą udział w utrzymaniu homeostazy komórki, usuwaniu toksycznych związków i eksporcie determinantów zjadliwości . Mają szerokie spektrum substratów i w przypadku ich nadmiernej ekspresji mogą prowadzić do zmniejszonej aktywności niepowiązanych klas leków. Pierwsze doniesienia o lekoopornych zakażeniach bakteryjnych pojawiły się w latach czterdziestych XX wieku, po pierwszej masowej produkcji antybiotyków . Większość systemów transportu nadrodziny RND składa się z dużych łańcuchów polipeptydowych. Białka RND występują głównie u bakterii Gram-ujemnych, ale można je również znaleźć u bakterii Gram-dodatnich , archeonów i eukariontów .
Funkcjonować
Białko RND wyznacza substrat dla kompletnych systemów transportowych, w tym: jonów metali , ksenobiotyków czy leków . Transport hydrofobowych i amfifilowych realizuje podrodzina HAE-RND. Podczas usuwania metali ciężkich odbywa się HME-RND.
Mechanizm i konstrukcja
Białka RND są duże i mogą zawierać ponad 1000 reszt aminokwasowych . Na ogół składają się z dwóch homologicznych podjednostek (co sugeruje, że powstały w wyniku wewnątrzgenowego zdarzenia duplikacji tandemowej, które miało miejsce w układzie pierwotnym przed rozbieżnością członków rodziny), z których każda zawiera pętlę peryplazmatyczną sąsiadującą z 12 helisami transbłonowymi . Z dwunastu helis na N-końcu znajduje się pojedynczy klucz transbłonowy (TMS). po której następuje duża domena pozacytoplazmatyczna, następnie sześć dodatkowych TMS, druga duża domena pozacytoplazmatyczna i pięć końcowych TMS na C-końcu. TM4 reguluje specyficzność dla konkretnego substratu w danym białku RND. Dlatego TM4 może być wskaźnikiem specyficzności RND bez wyraźnej wiedzy o pozostałej części białka.
Pompy RND są cytoplazmatyczną częścią kompletnego trójdzielnego kompleksu (ryc. 1), który rozprzestrzenia się przez błonę zewnętrzną i wewnętrzną bakterii Gram-ujemnych, co jest również powszechnie określane jako system wypływu CBA. Białko RND łączy się z kanałem błony zewnętrznej i peryplazmatycznym , a połączenie wszystkich trzech białek umożliwia systemowi eksport substratów do pożywki zewnętrznej, zapewniając bakteriom ogromną przewagę .
Białko CusA, transporter będący członkiem HME-RND, udało się wykrystalizować , dostarczając cennych informacji strukturalnych na temat pomp HME-RND. CusA występuje jako homotrimer , a każda jednostka składa się z 12 helis transbłonowych (TM1-TM12). Domena peryplazmatyczna składa się z dwóch helis, TM2 i TM8. Ponadto domena peryplazmatyczna składa się z sześciu subdomen, PN1, PN2, PC1, PC2, DN, DC, które tworzą centralny por i domenę dokową. Centralny por jest utworzony przez PN1, PN2, PC1, PC2 i razem stabilizują trimeryczną organizację homotrimeru .
Wypływ jonów metali (HME-RND)
Rodzina HME-RND działa jako centralna pompa białkowa w wypływie jonów metali, zasilana przez antyport proton-substrat . Rodzina obejmuje pompy eksportujące metale jednowartościowe – system Cus oraz pompy eksportujące metale dwuwartościowe – system Czc.
na metale ciężkie rodziny RND została po raz pierwszy odkryta u R. metallidurans poprzez białko CzcA, a później CnrA. Najlepiej scharakteryzowane białka RND obejmują CzcCBA (Cd 2+ , Zn 2+ i Co 2+ ), CnrCBA (Ni 2+ i Co 2+ ) i NccCBA (Ni 2+ , Co 2+ i Cd 2+ ) w Cupriavidus , Czr (odporność na Cd 2+ i Zn 2+ ) u Pseudomonas aeruginosa , i Czn (oporność na Cd2 + , Zn2 + i Ni2 + ) w Helicobacter pylori . Zaproponowano, że wypływ jonów metali zachodzi z cytoplazmy i peryplazmy w oparciu o lokalizację wielu miejsc wiązania substratu na białku RND.
CznCBA
System Czn utrzymuje homeostazę odporności na kadm , cynk i nikiel ; bierze udział w ureazy i kolonizacji żołądka przez H. pylori . Dominującą rolę w homeostazie niklu odgrywają białka CznC i CznA.
CzcCBA
Czc nadaje odporność na kobalt , cynk i kadm . Operon CzcCBA obejmuje: CzcA (białko specyficzne dla rodziny RND), fuzyjne błony (MFP) CzcB i białko czynnika błony zewnętrznej (OMF) CzcC, z których wszystkie tworzą aktywny kompleks trójdzielny, oraz czcoperon . Ekspresja operonu jest regulowana przez jony metali.
Lekooporność (HAE-RND)
Rodzina RND odgrywa ważną rolę w wytwarzaniu wewnętrznej i podwyższonej oporności wielolekowej u bakterii Gram-ujemnych. Eksport amfifilowych i hydrofobowych reguluje rodzina HAE-RND. W E. coli zidentyfikowano pięć pomp RND: AcrAB, AcrAD, AcrEF, MdtEF i MdtAB. Chociaż nie jest jasne, jak trójczęściowy kompleks działa u bakterii, zaproponowano dwa mechanizmy: model mostkowania adaptera i model zawijania adaptera . [ potrzebne źródło ]
Zaangażowanie HAE-RND w detoksykację i eksport substratów organicznych umożliwiło niedawną charakterystykę konkretnych pomp ze względu na ich rosnące znaczenie medyczne. Połowę oporności na antybiotyki wykazanej u szpitalnych szczepów Pseduomonas aeruginosa in vivo przypisano białkom wypływowym RND. P. aeruginosa zawiera 13 systemów transportowych RND, w tym jeden HME-RND i pozostałe HAE-RND. Do najlepiej zidentyfikowanych należą białka Mex: MexB, MexD i MexF, które detoksykują substancje organiczne . Proponuje się, aby systemy MexB wykazywały specyficzność substratową dla beta-laktamów ; podczas gdy system MexD wyraża specyficzność dla związków cefemowych.
E. coli – AcrB
U E. coli oporność wielolekowa rozwija się w wyniku różnych mechanizmów. Szczególnie niepokojąca jest zdolność mechanizmów wypływu do nadawania oporności o szerokim spektrum działania. Pompy wypływowe RND zapewniają wytłaczanie szeregu związków. Sklasyfikowano pięć transporterów białek w komórkach E. coli należących do podrodziny HAE-RND, w tym wielolekowe białko wypływowe AcrB, białko błony zewnętrznej TolC i peryplazmatyczne białko adaptorowe AcrA. Białka TolC i AcrA są również wykorzystywane w trójdzielnym kompleksie w innych zidentyfikowanych białkach wypływu RND. System wypływu AcrAB-TolC jest odpowiedzialny za wypływ leków przeciwdrobnoustrojowych, takich jak penicylina G , kloksacylina , nafcylina , makrolidy , nowobiocyna , linezolid i antybiotyki zawierające kwas fusydowy . Inne podłoża obejmują barwniki, detergenty, niektóre rozpuszczalniki organiczne i hormony steroidowe . Sposoby, w jakie domeny lipofilowe substratu i pompy RND nie są do końca zdefiniowane. [ potrzebne źródło ]
Skrystalizowane białko AcrB zapewnia wgląd w mechanizm działania białek HAE-RND i innych białek z rodziny RND.
Wypływ transportu wielolekowego (Mdt).
Mdt(A) to pompa usuwająca, która nadaje oporność na różne leki. Wyraża się w L. lactis , E. coli i różnych innych bakteriach. W przeciwieństwie do innych białek RND, Mdt(A) zawiera przypuszczalne miejsce wiązania ATP i dwa motywy C zachowane w piątym TMS. Mdt skutecznie zapewnia bakteriom oporność na tetracyklinę , chloramfenikol , linkozamidy i streptomycynę . Źródło energii dla aktywnego wypływu przez Mdt(A) jest obecnie nieznane.