RÓŻOWY1
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PINK1 | |||||||||||||||||||||||||||||||||||||||||||||||
| , BRPK, PARK6, przypuszczalna kinaza 1 indukowana przez PTEN, kinaza 1 indukowana przez PTEN | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Kinaza indukowana przez PTEN 1 ( PINK1 ) jest mitochondrialną serynowo / treoninową kinazą białkową kodowaną przez gen PINK1 .
Uważa się, że chroni komórki przed dysfunkcjami mitochondriów wywołanymi stresem . Aktywność PINK1 powoduje, że białko parkiny wiąże się ze zdepolaryzowanymi mitochondriami, indukując autofagię tych mitochondriów. PINK1 jest przetwarzany przez zdrowe mitochondria i uwalniany w celu wywołania różnicowania neuronów. Mutacje w tym genie powodują jedną z form autosomalnej recesywnej choroby Parkinsona o wczesnym początku .
Struktura
PINK1 jest syntetyzowany jako białko o masie 63000 Da , które jest często cięte przez PARL między resztami 103-alaniny i 104-fenyloalaniny na fragment o masie 53000 Da. PINK1 zawiera N-końcową sekwencję lokalizacji mitochondrialnej, przypuszczalną sekwencję transbłonową, domenę kinazy Ser/Thr i C-końcową sekwencję regulatorową. Stwierdzono, że białko lokalizuje się w zewnętrznej błonie mitochondriów, ale można je również znaleźć w całym cytozolu. Eksperymenty sugerują, że domena kinazy Ser/Thr jest skierowana na zewnątrz w kierunku cytozolu, co wskazuje na możliwy punkt interakcji z parkiną.
Struktura PINK1 została rozwiązana i pokazuje, w jaki sposób białko wiąże i fosforyluje swój substrat ubikwitynę.
Funkcjonować
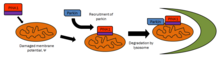
PINK1 jest ściśle zaangażowany w kontrolę jakości mitochondriów, identyfikując uszkodzone mitochondria i ukierunkowując określone mitochondria na degradację. Zdrowe mitochondria utrzymują potencjał błonowy, który można wykorzystać do importu PINK1 do błony wewnętrznej, gdzie jest on rozszczepiany przez PARL i usuwany z błony zewnętrznej. Poważnie uszkodzone mitochondria nie mają wystarczającego potencjału błonowego do importowania PINK1, który następnie gromadzi się na błonie zewnętrznej. Następnie PINK1 rekrutuje parkin, aby celował w uszkodzone mitochondria w celu degradacji poprzez autofagię . Ze względu na obecność PINK1 w całej cytoplazmie zasugerowano, że PINK1 działa jako „zwiadowca” do sondowania uszkodzonych mitochondriów.

PINK1 może również kontrolować jakość mitochondriów poprzez rozszczepienie mitochondriów . W wyniku rozszczepienia mitochondriów powstaje wiele mitochondriów potomnych, często z nierównomiernym rozkładem potencjału błonowego. Mitochondria o silnym, zdrowym potencjale błonowym były bardziej podatne na fuzję niż mitochondria o niskim potencjale błonowym. Zakłócenie szlaku rozszczepienia mitochondriów doprowadziło do wzrostu utlenionych białek i zmniejszenia oddychania. Bez PINK1 parkin nie może skutecznie zlokalizować uszkodzonych mitochondriów, podczas gdy nadekspresja PINK1 powoduje, że parkin lokalizuje się nawet w zdrowych mitochondriach. Ponadto mutacje zarówno w Drp1, mitochondrialnym czynniku rozszczepienia, jak i PINK1 były śmiertelne Drosophila . Jednak nadekspresja Drp1 może uratować osoby z niedoborem PINK1 lub parkiny, co sugeruje, że rozszczepienie mitochondrialne zainicjowane przez Drp1 odtwarza te same efekty szlaku PINK1 / parkin.
Oprócz rozszczepienia mitochondriów, PINK1 jest zaangażowany w ruchliwość mitochondriów. Akumulacja PINK1 i rekrutacja parkin celują w mitochondrium do degradacji, a PINK1 może służyć do zwiększania szybkości degradacji poprzez zatrzymanie ruchliwości mitochondriów. Nadekspresja PINK1 dała efekty podobne do wyciszenia Miro , białka ściśle związanego z migracją mitochondriów.
Inny mechanizm kontroli jakości mitochondriów może wynikać z pęcherzyków pochodzących z mitochondriów. Stres oksydacyjny w mitochondriach może wytwarzać potencjalnie szkodliwe związki, w tym nieprawidłowo sfałdowane białka lub reaktywne formy tlenu. Wykazano, że PINK1 ułatwia tworzenie pęcherzyków pochodzących z mitochondriów, które mogą oddzielać reaktywne formy tlenu i przenosić je do lizosomów w celu degradacji.
Znaczenie choroby
Choroba Parkinsona często charakteryzuje się degeneracją neuronów dopaminergicznych i jest związana z gromadzeniem się nieprawidłowo sfałdowanych białek i ciałek Lewy'ego . Wykazano, że mutacje w białku PINK1 prowadzą do gromadzenia się takich nieprawidłowo sfałdowanych białek w mitochondriach zarówno much, jak i komórek ludzkich. W szczególności mutacje w domenie kinazy serynowo-treoninowej stwierdzono u wielu pacjentów z chorobą Parkinsona, u których PINK1 nie chroni przed dysfunkcją mitochondriów wywołaną stresem i apoptozą .
Manipulacja farmakologiczna
Do tej pory było niewiele doniesień o małych cząsteczkach aktywujących PINK1 i ich obietnicy jako potencjalnych metod leczenia choroby Parkinsona. Pierwszy raport pojawił się w 2013 roku, kiedy Kevan Shokat i jego zespół z UCSF zidentyfikowali nukleozasadę zwaną kinetyną jako aktywator PINK1. Następnie inni wykazali, że nukleozydowa pochodna kinetyny, tj. rybozyd kinetyny, wykazywała znaczącą aktywację PINK1 w komórkach. Ponadto monofosforanowe proleki rybozydu kinetyny, ProTides, również wykazywały aktywację PINK1. W grudniu 2017 r. niklosamid, lek przeciw robakom, został zidentyfikowany jako silny aktywator PINK1 w komórkach i neuronach.
Dalsza lektura
- Heutink P (2006). „PINK-1 i DJ-1 - nowe geny choroby Parkinsona dziedziczonej autosomalnie recesywnie”. PINK-1 i DJ-1 – nowe geny autosomalnej recesywnej choroby Parkinsona . J. Transmisja neuronowa. Dodatek . Dziennik transmisji neuronowej . Uzupełnienie. Tom. 70. s. 215–9. doi : 10.1007/978-3-211-45295-0_33 . ISBN 978-3-211-28927-3 . PMID 17017532 .
- Valente EM, Bentivoglio AR, Dixon PH, Ferraris A, Ialongo T, Frontali M, Albanese A, Wood NW (2001). „Lokalizacja nowego locus dla autosomalnego recesywnego parkinsonizmu o wczesnym początku, PARK6, na ludzkim chromosomie 1p35-p36” . Jestem. J. Hum. Genet . 68 (4): 895–900. doi : 10.1086/319522 . PMC 1275643 . PMID 11254447 .
- Khan NL, Valente EM, Bentivoglio AR, Wood NW, Albanese A, Brooks DJ, Piccini P (2002). „Kliniczna i subkliniczna dysfunkcja dopaminergiczna w parkinsonizmie związanym z PARK6: badanie PET 18F-dopa”. Ann. Neurol . 52 (6): 849–53. doi : 10.1002/ana.10417 . PMID 12447943 . S2CID 9275470 .
- Bonifati V, Dekker MC, Vanacore N, Fabbrini G, Squitieri F, Marconi R, Antonini A, Brustenghi P, Dalla Libera A, De Mari M, Stocchi F, Montagna P, Gallai V, Rizzu P, van Swieten JC, Oostra B , van Duijn CM, Meco G, Heutink P (2003). „Autosomalny recesywny parkinsonizm o wczesnym początku jest powiązany z trzema loci: PARK2, PARK6 i PARK7” . Neurol. nauka . 23 Suppl 2: S59–60. doi : 10.1007/s100720200069 . PMID 12548343 . S2CID 13625056 .
- Valente EM, Brancati F, Caputo V, Graham EA, Davis MB, Ferraris A, Breteler MM, Gasser T, Bonifati V, Bentivoglio AR, De Michele G, Dürr A, Cortelli P, Filla A, Meco G, Oostra BA, Brice A, Albanese A, Dallapiccola B, Wood NW (2003). „PARK6 jest częstą przyczyną rodzinnego parkinsonizmu” . Neurol. nauka . 23 Dodatek 2: S117–8. doi : 10.1007/s100720200097 . PMID 12548371 . S2CID 21061495 .
- Nakajima A, Kataoka K, Hong M, Sakaguchi M, Huh NH (2004). „BRPK, nowa kinaza białkowa wykazująca zwiększoną ekspresję w mysich liniach komórkowych raka o wyższym potencjale przerzutowym”. Rak Lett . 201 (2): 195–201. doi : 10.1016/S0304-3835(03)00443-9 . PMID 14607334 .
- Valente EM, Abou-Sleiman PM, Caputo V, Muqit MM, Harvey K, Gispert S, Ali Z, Del Turco D, Bentivoglio AR, Healy DG, Albanese A, Nussbaum R, González-Maldonado R, Deller T, Salvi S, Cortelli P, Gilks WP, Latchman DS, Harvey RJ, Dallapiccola B, Auburger G, Wood NW (2004). „Dziedziczna choroba Parkinsona o wczesnym początku spowodowana mutacjami w PINK1”. nauka . 304 (5674): 1158–60. Bibcode : 2004Sci...304.1158V . doi : 10.1126/science.1096284 . PMID 15087508 . S2CID 33630092 .
- Healy DG, Abou-Sleiman PM, Ahmadi KR, Muqit MM, Bhatia KP, Quinn NP, Lees AJ, Latchmann DS, Goldstein DB, Wood NW (2004). „Gen odpowiedzialny za chorobę Parkinsona PARK6, PINK1, nie wpływa na powszechne formy parkinsonizmu” . Ann. Neurol . 56 (3): 329–35. doi : 10.1002/ana.20206 . PMID 15349859 . S2CID 1235813 .
- Hatano Y, Li Y, Sato K, Asakawa S, Yamamura Y, Tomiyama H, Yoshino H, Asahina M, Kobayashi S, Hassin-Baer S, Lu CS, Ng AR, Rosales RL, Shimizu N, Toda T, Mizuno Y, Hattori N. (2004). „Nowe mutacje PINK1 w parkinsonizmie o wczesnym początku”. Ann. Neurol . 56 (3): 424–7. doi : 10.1002/ana.20251 . PMID 15349870 . S2CID 10853835 .
- Hatano Y, Sato K, Elibol B, Yoshino H, Yamamura Y, Bonifati V, Shinotoh H, Asahina M, Kobayashi S, Ng AR, Rosales RL, Hassin-Baer S, Shinar Y, Lu CS, Chang HC, Wu-Chou YH, Ataç FB, Kobayashi T, Toda T, Mizuno Y, Hattori N (2004). „Powiązany z PARK6 autosomalny recesywny parkinsonizm o wczesnym początku w populacjach azjatyckich”. Neurologia . 63 (8): 1482–5. doi : 10.1212/01.wnl.0000142258.29304.fe . PMID 15505170 . S2CID 13480500 .
- Healy DG, Abou-Sleiman PM, Gibson JM, Ross OA, Jain S, Gandhi S, Gosal D, Muqit MM, Wood NW, Lynch T (2006). „Choroba Parkinsona związana z PINK1 (PARK6) w Irlandii” . Neurologia . 63 (8): 1486-8. doi : 10.1212/01.wnl.0000142089.38301.8e . PMID 15505171 . S2CID 24418905 .
- Rogaeva E, Johnson J, Lang AE, Gulick C, Gwinn-Hardy K, Kawarai T, Sato C, Morgan A, Werner J, Nussbaum R, Petit A, Okun MS, McInerney A, Mandel R, Groen JL, Fernandez HH, Postuma R, Foote KD, Salehi-Rad S, Liang Y, Reimsnider S, Tandon A, Hardy J, St George-Hyslop P, Singleton AB (2005). „Analiza genu PINK1 w dużej kohorcie przypadków z chorobą Parkinsona” . Archiwa neurologii . 61 (12): 1898–904. doi : 10.1001/archneur.61.12.1898 . PMID 15596610 .
- Beilina A, Van Der Brug M, Ahmad R, Kesavapany S, Miller DW, Petsko GA, Cookson MR (2005). „Mutacje w domniemanej kinazie 1 indukowanej przez PTEN, związane z parkinsonizmem recesywnym, mają zróżnicowany wpływ na stabilność białek” . proc. Natl. Acad. nauka USA . 102 (16): 5703–8. Bibcode : 2005PNAS..102.5703B . doi : 10.1073/pnas.0500617102 . PMC 556294 . PMID 15824318 .
- Deng H, Le WD, Zhang X, Pan TH, Jankovic J (2005). „Mutacje G309D i W437OPA PINK1 u pacjentów z chorobą Parkinsona rasy kaukaskiej” . Acta Neurol. Skanuj . 111 (6): 351–2. doi : 10.1111/j.1600-0404.2005.00383.x . PMID 15876334 . S2CID 10669009 .
- Li Y, Tomiyama H, Sato K, Hatano Y, Yoshino H, Atsumi M, Kitaguchi M, Sasaki S, Kawaguchi S, Miyajima H, Toda T, Mizuno Y, Hattori N (2005). „Badanie kliniczne mutacji PINK1 w autosomalnym recesywnym parkinsonizmie o wczesnym początku”. Neurologia . 64 (11): 1955–7. doi : 10.1212/01.WNL.0000164009.36740.4E . PMID 15955953 . S2CID 46024206 .