Peptydowy kompleks ładujący
Kompleks ładujący peptyd ( PLC) to krótkotrwały, wielopodjednostkowy kompleks białek błonowych , który znajduje się w retikulum endoplazmatycznym (ER). Organizuje peptydów przez główne cząsteczki kompleksu zgodności tkankowej klasy I (MHC-I) . Stabilne kompleksy peptyd-MHC I są uwalniane na powierzchnię komórki w celu promowania komórek T przeciwko komórkom złośliwym lub zakażonym. Z kolei limfocyty T rozpoznają aktywowane peptydy, które mogą być immunogenne lub nieimmunogenne .
Przegląd
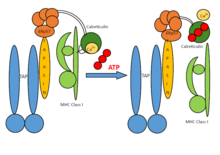
Zespół PLC składa się z siedmiu podjednostek, w tym transporterów związanych z przetwarzaniem antygenu (TAP1 i TAP2 – wspólnie określanych jako TAP), oksydoreduktazy ERp57 , heterodimeru MHC-I oraz białek opiekuńczych , tapasyny i kalretikuliny . TAP transportuje produkty degradacji proteasomów z cytozolu do światła ER, gdzie są ładowane na cząsteczki MHC-I. Kompleksy peptyd-MHC-I przemieszczają się następnie drogą wydzielniczą na powierzchnię komórki, prezentując swój ładunek antygenowy cytotoksycznym komórkom T.
Ogólnie rzecz biorąc, wstępne łańcuchy ciężkie MHC-I są nadzorowane przez układ kalneksyna-kalretikulina w ER. Wraz z β2-mikroglobuliną (β2m), ciężkie łańcuchy MHC-I tworzą zespoły heterodimerów, które działają jako receptory dla peptydów antygenowych. Puste heterodimery MHC-I są rekrutowane przez kalretikulinę i tworzą krótkotrwałe makrocząsteczkowe PLC, w których tapasyna opiekuńcza dodatkowo zapewnia stabilizację w cząsteczkach MHC-I. Ponadto ERp57 i tapasyna tworzą dwusiarczek -połączone koniugaty, a tapasyna ma kluczowe znaczenie dla utrzymania stabilności strukturalnej PLC, a także ułatwienia optymalnego ładowania peptydów. Po końcowej kontroli jakości, podczas której heterodimery MHC-I przechodzą edycję peptydów, stabilne kompleksy peptyd-MHC-I są uwalniane na powierzchnię komórki w celu rozpoznania przez komórki T. PLC może służyć wielu różnym allomorfom MHC-I , odgrywając tym samym centralną rolę w różnicowaniu i primowaniu limfocytów T oraz w kontrolowaniu infekcji wirusowych i rozwoju nowotworu.
Struktura
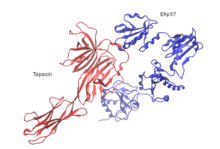
Jak dotąd tylko struktura ludzkiego PLC została wyjaśniona za pomocą kriomikroskopii elektronowej pojedynczych cząstek (cryo-EM). Organizacja strukturalna składa się z cząsteczek tapasyny, kalretikuliny, ERp57 i MHC-I, które są skupione wokół TAP i mają pseudosymetryczną orientację. Rozmiar PLC to 150 Å na 150 Å z całkowitą wysokością 240 Å w poprzek membrany ER. Dwie przeciwstawne cząsteczki tapasyny kształtują centralną domenę w PLC. W tym modelu reszta E225 N-końcowej domeny podobnej do immunoglobuliny jednej cząsteczki i R60, która znajduje się w motywie krótkiej helisy siedmioniciowej N-końcowej beczki β drugiej cząsteczki, w odległości mostka solnego . Reszty te są zachowane wśród kręgowców szczękowych, ale brakuje ich u ptasich PLC. Jest to zgodne z istnieniem pojedynczej kopii tapasyny w ptasim PLC i brakiem N-końcowej domeny transbłonowej (TMD0) w ptasim TAP1. Domeny światła ER przeciwstawnych cząsteczek tapasyny są nachylone względem siebie pod kątem 30°, ustawiając dwa punkty wejścia do błony helisy transbłonowe oddalone od siebie o 60 Å. Powstały skręt domeny wyklucza wiązanie kalretikuliny lub kalneksyny z glikanem dimerycznego rusztowania tapasyny i wyjaśnia, dlaczego tylko dojrzała tapasyna może składać się w PLC. Inną cechą strukturalną jest to, że ERp57 w swojej typowej konformacji w kształcie litery U jest skompleksowany z tapasyną poprzez aktywne katalitycznie domeny a i a′. Nieoczekiwana orientacja tapasyny umożliwia C-końcowemu wydłużeniu domeny a′ trans ERp57 interakcję z C-końcową domeną podobną do immunoglobuliny tapasyny cis, potencjalnie zwiększając stabilność PLC.
Ta struktura krio-EM ujawnia wysoki stopień plastyczności N-końcowej kanapki z trzema arkuszami β tapasyny i pokazuje, że elastyczne mocowanie MHC-I jest niezbędne, aby tapasyna mogła wykonywać swoją funkcję korekty. Kalretikulina ma kluczowe znaczenie i jest wysoce zależna od montażu i dojrzewania MHC-I w PLC. Kulista domena lektynowa kalretikuliny zawiera miejsce wiązania glikanu, które wyczuwa ugrupowania monoglukozowe N-rdzeniowego glikozylowanego MHC-I zanim zwiąże się z tapasyną. Monoglukozylowana gałąź N-rdzeniowego glikanu, która pochodzi z N86 MHC-I, wiąże się z powierzchnią wiążącą glikan kalretikuliny, podczas gdy inna gałąź mannozy prawdopodobnie leży blisko reszt na krawędzi β-kanapki lektynowej. Zgodnie z proponowaną zależną od wapnia aktywnością wykrywania lipidów, C-końcowy kwaśny ogon kalretikuliny wskazuje na ulotkę błony ER-luminalnej, gdzie znajduje się blisko C-końcowej domeny podobnej do immunoglobuliny tapasyny. W strukturze krio-EM kładzie się nacisk na centralną rolę C-końcowej domeny podobnej do immunoglobuliny tapasyny, która działa jako niezbędny wielowartościowy rdzeń interakcji dla pozostałych podjednostek PLC. Centralna wnęka, która łączy wyjście szlaku translokacji peptydów TAP ze światłem ER przez dwa boczne okna, może służyć jako kosz molekularny dla transportowanych peptydów, zanim zostaną one edytowane przez aminopeptydazy rezydujące w ER.
UZYSKIWAĆ
TAP jest heterodimerycznym kompleksem składającym się z członków TAP1 (ABCB2) i TAP2 (ABCB3) z nadrodziny transporterów ABC. Wspólną cechą wszystkich transporterów ABC jest ich organizacja: 1) w dwie domeny transbłonowe (TMD) i 2) w dwie nukleotydy (NBD). Obie domeny wewnątrzcząsteczkowe są ze sobą sprzężone, a gdy trwa wiązanie ATP , konformacyjne zmiany w TMD umożliwiają przemieszczanie się produktów degradacji proteasomów przez błonę. TAP rozpoznaje i transportuje peptydy antygenowe wytwarzane w cytosolu wprost do ER, podczas gdy tapasin rozpoznaje rodzaj peptydów, które mają zdolność tworzenia stabilnych kompleksów z MHC-I. Ten proces jest znany jako korekta lub edycja peptydów. Peptydy wybrane poprzez korektę poprawiają stabilność MHC-I; tapasin przyczynia się również do edycji immunogennych epitopów peptydowych. Jednak dopiero niedawno udowodniono w badaniach biochemicznych, biofizycznych i strukturalnych, że kluczową funkcją odporności nabytej, katalitycznej Mechanizm korekty peptydów jest wykonywany przez tapasynę i TAPBPR (białko wiążące TAP, homolog tapasyny).
tapasin
Cresswell i współpracownicy jako pierwsi odkryli tapasynę (glikoproteinę związaną z TAP) jako białko 48 kDa w kompleksach wyizolowanych z przeciwciałami TAP1 z lizatów digitoniny ludzkich komórek limfoblastoidalnych B. Tapasin wiąże HC/β2m wraz z białkami opiekuńczymi ER z transporterem peptydów. Znajduje się w ER, a jego funkcja polega na utrzymywaniu razem cząsteczek klasy I razem z chaperonem kalretikuliną i ERp57 do TAP. Badania linii komórkowej z niedoborem tapasyny i od myszy z uszkodzonym genem tapasyny, krótkotrwałym kompleksem cząsteczek klasy I. [ wymagane wyjaśnienie ]
Tapasyna i TAP są bardzo ważne dla stabilizacji cząsteczek klasy I, a także dla optymalizacji peptydu prezentowanego cytotoksycznym limfocytom T. Odkryto niezależne od PLC białko homologu tapasyny o nazwie TAPBPR, które ma zdolność działania jako drugi korektor lub edytor peptydów specyficznych dla MHC-I, ale nie posiada domeny transbłonowej. Tapasin i TAPBPR mają podobne interfejsy wiążące na MHC-I, jak pokazano w strukturze rentgenowskiej TAPBPR z MHC-I (łańcuch ciężki i mikroglobulina β2). Zastosowanie fotorozszczepialnego peptydu o wysokim powinowactwie umożliwiło naukowcom utworzenie stabilnych (związanych) cząsteczek MHC-I, a następnie utworzenie stabilnego kompleksu TAPBPR i MHC-I z rozszczepieniem fotoindukowanego peptydu pod wpływem światła UV.
ERp57
ERp57 jest enzymem z rodziny oksydoreduktaz tiolowych zlokalizowanym w ER. Jest przyłączany do substratów w sposób pośredni poprzez asocjację z molekularną kalretikuliną opiekuńczą kompleksu ładującego peptyd. We wczesnych stadiach wytwarzania cząsteczek MHC-I, ERp57 jest związany z wolnymi łańcuchami ciężkimi MHC-I. W rezultacie o jego funkcji decyduje tworzenie wiązań dwusiarczkowych w łańcuchach ciężkich, utleniające fałdowanie łańcucha ciężkiego i wreszcie fakt, że ERp57 ładuje peptydy do cząsteczek MHC-I.
MHC-I
Wstępne łańcuchy ciężkie MHC-I tworzą białka opiekuńcze za pomocą kompleksu kalneksyna-kalretikulina w ER. Oprócz tego β2-mikroglobulina (β2m) jest przyłączona do łańcuchów ciężkich heterodimerów i jako całość działają one jako receptory dla peptydów antygenowych. Kiedy łańcuchy MHC-I są puste, są rekrutowane przez kalretikulinę i tworzą przejściowy PLC.
Tapasin regularnie odgrywa rolę w stabilizacji MHC-I. Dopiero po wdrożeniu heterodimerów MHC-I do korekty lub edycji peptydów, stabilne kompleksy pMHC-I (peptyd-MHC-I) są uwalniane na powierzchnię komórki w celu rozpoznania i zniszczenia komórek zakażonych wirusem lub złośliwych komórek nowotworowych . Ogólnie rzecz biorąc, każdy pojedynczy organizm posiada zbiór sześciu cząsteczek MHC-I (po trzy od każdego rodzica). Tak więc w autoimmunologicznych zgodnymi dawcami są krewni, którzy posiadają podobny zbiór cząsteczek MHC-I, oprócz tych biorcy. [ potrzebne źródło ]
kalretikulina
Kalretikulina – zwłaszcza jej domena podobna do lektyny – oddziałuje z MHC-I. Domena P jest zwrócona w stronę miejsca wiązania peptydu MHC-I w kierunku ERp57. Ta orientacja umożliwia tapasinowi przyłączenie i zabezpieczenie MHC-I. Ta translokacja TAP ułatwia jego otwarcie do jamy luminalnej ER, otoczonej standardowymi punktami wejścia błony, takimi jak te dla tapasyny i MHC-I. Te dwa punkty wejścia ułatwiają rekrutację MHC-I z optymalnym obciążeniem peptydem i ostatecznym uwolnieniem MHC-I na powierzchni komórek T w celu rozpoznania. [ potrzebne źródło ]