Równanie Tafela
Równanie Tafela jest równaniem w kinetyce elektrochemicznej wiążącym szybkość reakcji elektrochemicznej z nadpotencjałem . Równanie Tafela zostało najpierw wydedukowane eksperymentalnie, a później wykazano, że ma teoretyczne uzasadnienie. Równanie nosi imię szwajcarskiego chemika Juliusa Tafela .
„Opisuje, w jaki sposób prąd elektryczny przepływający przez elektrodę zależy od różnicy napięcia między elektrodą a elektrolitem w masie w przypadku prostej, jednocząsteczkowej reakcji redoks”. [ odniesienie cykliczne ]
Tam, gdzie reakcja elektrochemiczna zachodzi w dwóch połówkowych reakcjach na oddzielnych elektrodach , równanie Tafela jest stosowane do każdej elektrody osobno. Na pojedynczej elektrodzie równanie Tafela można zapisać jako:
-
()
Gdzie
- znak plus pod wykładnikiem odnosi się do reakcji anodowej, a znak minus do reakcji katodowej [ odniesienie kołowe ] ,
- : nadpotencjał , V
- : „ Nachylenie Tafel ”, V
- : gęstość prądu , A / m 2
- : „ gęstość prądu wymiany ”, A / m 2 .
Weryfikacja oraz dalsze wyjaśnienie tego równania można znaleźć tutaj. Równanie Tafela jest przybliżeniem równania Butlera-Volmera w przypadku .
„[Równanie Tafela] zakłada, że stężenia na elektrodzie są praktycznie równe stężeniom w masie elektrolitu, co pozwala na wyrażenie prądu wyłącznie jako funkcja potencjału. Innymi słowy, zakłada się, że szybkość przenoszenia masy elektrody wynosi znacznie większa niż szybkość reakcji i że reakcja jest zdominowana przez wolniejszą szybkość reakcji chemicznej”. [ okólnik ]
Również przy danej elektrodzie równanie Tafela zakłada, że szybkość reakcji w odwrotnej połowie jest pomijalna w porównaniu z szybkością reakcji w przód.
Przegląd warunków
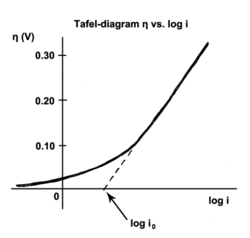
Prąd wymiany to prąd w stanie równowagi, tj. szybkość, z jaką utlenione i zredukowane związki przenoszą elektrony z elektrodą. Innymi słowy, gęstość prądu wymiany to szybkość reakcji przy potencjale odwracalnym (gdy z definicji nadpotencjał wynosi zero). Przy potencjale odwracalnym reakcja jest w równowadze, co oznacza, że reakcje do przodu i do tyłu postępują z tą samą szybkością. Ten kurs to gęstość prądu wymiany.
Nachylenie Tafela jest mierzone eksperymentalnie. Można jednak teoretycznie wykazać, że gdy dominujący mechanizm reakcji polega na przeniesieniu pojedynczego elektronu, to
gdzie A jest zdefiniowane jako
|
|
|
() |
Gdzie
- jest stałą Boltzmanna ,
- to temperatura bezwzględna ,
- to elementarny ładunek elektryczny elektronu,
- to napięcie termiczne i
- to „ współczynnik przenoszenia ładunku ”, którego wartość musi wynosić od 0 do 1.
Równanie w przypadku nie pomijalnego przenoszenia masy elektrody
W bardziej ogólnym przypadku
„Poniższe wyprowadzenie rozszerzonego równania Butlera-Volmera jest adaptacją wyprowadzenia Barda i Faulknera oraz Newmana i Thomasa-Alyei”. [ odniesienie cykliczne ] „[…] prąd jest wyrażony jako funkcja nie tylko potencjału (jak w prostej wersji), ale także danych stężeń. Szybkość przenoszenia masy może być stosunkowo niewielka, ale jej jedyna wpływ na reakcję chemiczną ma zmienione (dane) stężenia. W efekcie stężenia są również funkcją potencjału ”.
Równanie Tafela można również zapisać jako:
|
|
|
() |
Gdzie
- n to liczba wymienianych elektronów, jak w równaniu Nernsta ,
- k jest stałą szybkości reakcji elektrodowej w s −1 ,
- F jest stałą Faradaya ,
- C to stężenie substancji reaktywnych na powierzchni elektrody w molach/ m2 ,
- znak plus pod wykładnikiem odnosi się do reakcji anodowej, a znak minus do reakcji katodowej,
- R jest uniwersalną stałą gazową .
- to „ współczynnik przenoszenia ładunku ”, którego wartość musi wynosić od 0 do 1.
Demonstracja
Jak widać w równaniu ( 1 ),
Równanie w przypadku małych wartości polaryzacji
Inne równanie ma zastosowanie przy niskich wartościach polaryzacji . W takim przypadku zależność prądu od polaryzacji jest zwykle liniowa (nie logarytmiczna):
Ten obszar liniowy nazywany jest rezystancją polaryzacyjną ze względu na formalne podobieństwo do prawa Ohma .
Zobacz też
Dalsza lektura
- Burstein, GT (2005). „Stulecie równania Tafela: 1905–2005 pamiątkowe wydanie nauki o korozji”. Nauka o korozji . 47 (12): 2858–2870. doi : 10.1016/j.corsci.2005.07.002 .
Linki zewnętrzne
-
 Media związane z równaniem Tafela w Wikimedia Commons
Media związane z równaniem Tafela w Wikimedia Commons