Radykalny zegar
W chemii zegar rodnikowy jest związkiem chemicznym , który pomaga w pośredniej metodologii określania kinetyki reakcji wolnorodnikowej . Sam związek zegara rodnikowego reaguje ze znaną szybkością, co zapewnia kalibrację do określenia szybkości innej reakcji.
Wiele mechanizmów organicznych obejmuje półprodukty, których nie można bezpośrednio zidentyfikować, ale które można wywnioskować z reakcji wychwytywania. Kiedy takie półprodukty są rodnikami, ich czas życia można wywnioskować z radykalnych zegarów. Alternatywne, być może bardziej bezpośrednie podejście, obejmuje wytwarzanie i izolację półproduktów za pomocą fotolizy błyskowej i radiolizy impulsowej , ale takie metody są czasochłonne i wymagają drogiego sprzętu. Dzięki pośredniemu podejściu radykalnych zegarów nadal można uzyskać względne lub bezwzględne stałe szybkości bez potrzeby stosowania przyrządów lub sprzętu wykraczającego poza te normalnie potrzebne do badanej reakcji.
Teoria i technika
Radykalne reakcje zegarowe obejmują rywalizację między jednocząsteczkową reakcją rodnikową o znanej stałej szybkości i dwucząsteczkową reakcją rodnikową o nieznanej stałej szybkości w celu wytworzenia produktów nieułożonych i przegrupowanych. Przegrupowanie nieuporządkowanego rodnika U• prowadzi do powstania R• (reakcja zegarowa) o znanej stałej szybkości ( kr ). Te rodniki reagują ze środkiem wychwytującym AB, tworząc odpowiednio produkty nieuporządkowane i przegrupowane UA i RA.
Wydajność dwóch produktów można określić za pomocą chromatografii gazowej (GC) lub magnetycznego rezonansu jądrowego (NMR). Ze stężenia środka wychwytującego, znanej stałej szybkości zegara rodnikowego i stosunku produktów można pośrednio ustalić nieznaną stałą szybkości.
Jeśli istnieje równowaga chemiczna między U• i R•, przegrupowane produkty są dominujące. Ponieważ jednocząsteczkowa reakcja przegrupowania jest pierwszego rzędu, a dwucząsteczkowa reakcja pułapkowania jest drugiego rzędu (obie nieodwracalne), nieznaną stałą szybkości ( k R ) można wyznaczyć ze wzoru:
Stawki zegarowe
Siłą napędową radykalnych reakcji zegara jest ich zdolność do przestawiania. Niektóre typowe radykalne zegary to radykalne cyklizacje, otwarcia pierścieni i migracje 1,2. Dwa popularne przegrupowania to cyklizacja 5-heksenylu i otwarcie pierścienia cyklopropylometylu:

|

|
Rodnik 5-heksenylowy ulega cyklizacji, tworząc pięcioczłonowy pierścień, ponieważ jest to entropicznie i entalpicznie bardziej uprzywilejowane niż możliwość pierścienia sześcioczłonowego. Stała szybkości dla tej reakcji wynosi 2,3×105 s - 1 w temperaturze 298 K.
Rodnik cyklopropylometylu ulega bardzo szybkiemu przegrupowaniu otwarcia pierścienia, które zmniejsza napięcie pierścienia i jest entalpicznie korzystne. Stała szybkości dla tej reakcji wynosi 8,6×107 s - 1 w temperaturze 298 K.
Aby określić bezwzględne stałe szybkości reakcji rodnikowych, należy skalibrować reakcje zegara jednocząsteczkowego dla każdej grupy rodników, takich jak pierwszorzędowe alkile, w pewnym zakresie czasu. Za pomocą spektroskopii EPR można mierzyć bezwzględne stałe szybkości reakcji jednocząsteczkowych w różnych temperaturach. Równanie Arrheniusa można następnie zastosować do obliczenia stałej szybkości dla określonej temperatury, w której przeprowadzane są radykalne reakcje zegara.
Używając radykalnego zegara do badania reakcji, istnieje domniemane założenie, że szybkość przegrupowania zegara radykalnego jest taka sama, jak przy określaniu szybkości tej szybkości reakcji przegrupowania. Teoretyczne badanie reakcji przegrupowania cyklobutylometylu i 5-heksenylu w różnych rozpuszczalnikach wykazało, że charakter rozpuszczalnika tylko nieznacznie wpływał na ich szybkość reakcji.
Szybkości radykalnych zegarów można regulować, zwiększając lub zmniejszając, jakie rodzaje podstawników są przyłączone do zegara radykalnego. Na poniższym rysunku przedstawiono szybkości radykalnych zegarów z różnymi podstawnikami przyłączonymi do zegara. [ nieudana weryfikacja ]
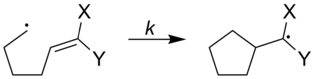
|
||
| X | Y | k (s -1 ) |
|---|---|---|
| Ph | Ph | 5x10 7 |
| OC 3 | H | 1,4x10 5 |
| OC 3 | CN | 2,5x10 8 |
| CN | H | 1,6x10 8 |
Wybierając spośród ogólnych klas radykalnych zegarów i określonych na nich podstawników, można wybrać stałą szybkości odpowiednią do badania reakcji o szerokim zakresie szybkości. Reakcje o szybkościach w zakresie od 10-1 do 1012 M - 1 s -1 badano przy użyciu radykalnych zegarów.
Przykłady użycia
Zegary rodnikowe stosuje się w redukcji przegrupowaniu Wittiga halogenków alkilowych naftalenkiem sodu , reakcjach enonów , , reakcjach redukcyjnej eliminacji związków dialkilortęci, dihydroksylacjach dioksranu i elektrofilowych fluorowaniach .
-
^ a b c d e f
Johnson, CC; Lippard, SJ; Liu, KE; Newcomb, M. (1993). „Sondy radykalnego zegara substratu i badania kinetycznych efektów izotopowych hydroksylacji węglowodorów przez monooksygenazę metanu”. J. Am. chemia soc . 115 (3): 939–947. doi : 10.1021/ja00056a018 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
^ ab Roschek
, B. Jr .; Tallman, Kalifornia; Rektor, CL; Gillmore, JG; Pratt, DA; Punta, C.; Porter, NA (2006). „Peroksylowe zegary radykalne”. J.Org. chemia . 71 (9): 3527–3532. doi : 10.1021/jo0601462 . PMID 16626136 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
^ a b c d e f g h
Griller, D .; Ingold, KU (1980). „Zegary wolnorodnikowe”. wg. chemia Rez . 13 (9): 317–323. doi : 10.1021/ar50153a004 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ a b Moss, RA; Platz, M.; Jones, M. Reaktywna chemia pośrednia. Wiley, John & Sons, Incorporated, 2004. 127–128.
-
^ a b c
Fu, Y .; Li, R.-Q.; Liu, L.; Guo, Q.-X. (2004). „Efekt rozpuszczalnika nie ma znaczenia dla szybkości radykalnego zegara”. Rez. chemia Pośredni . 30 (3): 279–286. doi : 10.1163/156856704323034012 . S2CID 96038335 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
^
Newcomb, M. (1993). „Metody i skale konkurencji dla kinetyki reakcji rodników alkilowych”. czworościan . 49 (6): 1151–1176. doi : 10.1016/S0040-4020(01)85808-7 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Lusztyk, J.; Ingold, KU (1991). „Kalibracja nowej horologii „zegarów” szybkich rodników. Szybkości otwierania pierścieni dla rodników cyklopropylokarbinylowych podstawionych pierścieniem i α-alkilem oraz rodnika bicyklo [2.1.0] pent-2-ylu”. J. Am. chemia soc . 113 (15): 5687–5698. doi : 10.1021/ja00015a024 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ Garst, John F.; Smith, Calvin D. (marzec 1976). „Przegrupowania Wittiga eterów aryloalkilowych”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 98 (6): 1526–1537. doi : 10.1021/ja00422a041 . ISSN 0002-7863 .
![{\displaystyle {\begin{array}{l}{\ce {U. + AB ->[k_R] {UA}+ B.}}\\{\bigg \downarrow }{k_{r}}\\{\ce {R. + AB -> {RA}+ B.}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4abb8b060be8190d61bdb4b7df1812862dca45d4)
![{\displaystyle k_{R}={\frac {k_{r}[{\ce {UA}}]}{{\ce {[AB][RA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82eef2a563a3b63951d50036a74666ea862bb854)