Resztkowe sprzężenie dipolarne
Resztkowe sprzężenie dipolarne między dwoma spinami w cząsteczce występuje, gdy cząsteczki w roztworze wykazują częściowe wyrównanie prowadzące do niepełnego uśrednienia przestrzennie anizotropowych sprzężeń dipolarnych .
Częściowe wyrównanie molekularne prowadzi do niepełnego uśrednienia anizotropowych oddziaływań magnetycznych, takich jak oddziaływanie dipol-dipol magnetyczny (zwane również sprzężeniem dipolarnym), anizotropia przesunięcia chemicznego lub oddziaływanie kwadrupolowe elektryczne . Wynikające z tego tak zwane szczątkowe anizotropowe oddziaływania magnetyczne stają się coraz ważniejsze w biomolekularnej spektroskopii NMR .
Historia i prace pionierskie
Spektroskopię NMR w ośrodkach częściowo zorientowanych odkryto po raz pierwszy w 1963 r., aw bardzo fundamentalnym artykule Alfred Saupe był w stanie przedstawić podstawową teorię opisu i zrozumienia obserwowalnych zjawisk zaledwie rok później. Po tej inicjacji odnotowano lawinę widm NMR w różnych fazach ciekłokrystalicznych (patrz np. ).
Drugą techniką częściowego wyrównania, która nie jest ograniczona minimalną anizotropią, jest wyrównanie wywołane odkształceniem w żelu (SAG), oparte na pionierskich pracach Deloche'a i Samulskiego. Technika ta była szeroko stosowana do badania właściwości żeli polimerowych za pomocą deuterowego NMR o wysokiej rozdzielczości, ale dopiero ostatnio zastosowano wyrównanie żelu do indukowania RDC w cząsteczkach rozpuszczonych w żelu. SAG umożliwia nieograniczone skalowanie wyrównania w szerokim zakresie i może być stosowany zarówno do rozpuszczalników wodnych, jak i organicznych, w zależności od użytego polimeru. Jako pierwszy przykład w rozpuszczalnikach organicznych, pomiary RDC w żelach rozciągniętego polistyrenu (PS) spęcznionych w CDCl 3 zostały zgłoszone jako obiecująca metoda wyrównania.
W 1995 roku James H. Prestegard i współpracownicy wykazali, że widma NMR niektórych białek (w tym przypadku cyjanometmioglobiny, która ma bardzo wysoce anizotropową podatność na działanie paramagnetyczne ), wykonane przy bardzo dużym polu, mogą zawierać dane, które mogą w użyteczny sposób uzupełniać NOE w określaniu trzeciorzędowego zginać.
W 1996 i 1997 roku Adriaan Bax i współpracownicy zmierzyli RDC w białku diamagnetycznym ( ubikwitynie ). Wyniki były dobrze zgodne ze strukturami krystalicznymi.
Fizyka
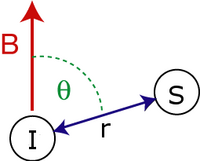
Świecki dipolarny sprzężenie dwóch spinów i jest określony wzorem:
Gdzie
- to zredukowana stała Plancka .
- i są żyromagnetycznymi odpowiednio wirowania wirowania
- to odległość między spinami.
- jest kątem między wektorem międzyspinowym a zewnętrznym polem magnetycznym .
- i są wektorami operatorów wirowania .
Powyższe równanie można przepisać w następującej postaci:
Gdzie
średnią wartość do zera. Nie obserwujemy zatem sprzężenia dipolarnego. Jeśli rozwiązanie nie jest izotropowe, to średnia wartość i można zaobserwować sprzężenia resztkowe
Należy zauważyć, że to resztkowe sprzężenie dipolarne może być dodatnie lub ujemne, w zależności od zakresu próbkowanych kątów.
Oprócz statycznej odległości i informacji kątowych, RDC mogą zawierać informacje o wewnętrznym ruchu cząsteczki. Każdemu atomowi w cząsteczce można przypisać tensor ruchu B , który można obliczyć z RDC zgodnie z następującą zależnością:
tensorem wyrównania molekularnego . Wiersze B zawierają tensory ruchu dla każdego atomu. Tensory ruchu mają również pięć stopni swobody . Z każdego tensora ruchu można obliczyć 5 interesujących parametrów. Zmienne Si 2 , ηi , αi , βi oraz γi są używane do określenia tych 5 parametrów dla atomu i. Si 2 to wielkość ruchu atomu i ; η i jest miarą anizotropii ruchu atomu i; α i oraz β i są związane ze współrzędnymi biegunowymi wektora wiązań wyrażonego w początkowym arbitralnym układzie odniesienia (tj. układzie PDB). Jeśli ruch atomu jest anizotropowy (tj. η i = 0), parametr końcowy, γ i, mierzy główną orientację ruchu.
Należy zauważyć, że parametry ruchu pochodzące z RDC są pomiarami lokalnymi.
Pomiar
Każdy pomiar RDC w roztworze składa się z dwóch etapów, wyrównania cząsteczek i badań NMR:
Metody wyrównywania cząsteczek
W przypadku cząsteczek diamagnetycznych przy umiarkowanym natężeniu pola, cząsteczki mają niewielką preferencję co do orientacji, wirujące próbki mają rozkład prawie izotropowy, a średnie sprzężenia dipolarne spadają do zera. W rzeczywistości większość cząsteczek ma preferowane orientacje w obecności pola magnetycznego, ponieważ większość z nich ma anizotropowe tensory podatności magnetycznej Χ.
Metoda jest najbardziej odpowiednia dla układów o dużych wartościach tensora podatności magnetycznej. Należą do nich: kompleks białko-kwas nukleinowy, kwasy nukleinowe , białka z dużą liczbą reszt aromatycznych , białka zawierające porfirynę i białka wiążące metale (metale mogą być zastąpione lantanowcami ) .
Dla w pełni zorientowanej cząsteczki, sprzężenie dipolarne dla grupy amidowej 1H - 15N wynosiłoby ponad 20 kHz , a para protonów oddzielonych od siebie o 5 Å miałaby sprzężenie do ~1 kHz. Jednak stopień wyrównania osiągnięty przez zastosowanie pola magnetycznego jest tak niski, że największe sprzężenia dipolarne 1H - 15N lub 1H - 13C mają <5 Hz. Dlatego zaprojektowano wiele różnych mediów wyrównujących:
- Bicele lipidowe (o dużej podatności magnetycznej): zmierzone RDC były rzędu setek Hz.
- ciekłokrystaliczne : zmierzone RDC mieściły się w zakresie od -40 do +20 Hz.
- Wirusy pałeczkowate, w tym bakteriofagi nitkowate (duża anizotropowa podatność magnetyczna).
- Nanorurki DNA (kompatybilne z detergentami stosowanymi do rozpuszczania białek błonowych)
Eksperymenty NMR
Istnieje wiele metod zaprojektowanych do dokładnego pomiaru stałej sprzężenia między jądrami. Zostały one podzielone na dwie grupy: metody oparte na częstotliwościach , w których separacja centrów pików (rozszczepienie) jest mierzona w dziedzinie częstotliwości, oraz metody oparte na intensywności , w których sprzężenie jest uzyskiwane z intensywności rezonansu zamiast rozdzielania. Obie metody uzupełniają się, ponieważ każda z nich obarczona jest innym rodzajem błędów systematycznych. Oto prototypowe przykłady eksperymentów NMR należących do każdej z dwóch grup:
- Metody intensywności : eksperyment ilościowy z modulacją J i metody z modulacją fazową
- metody rozdzielcze częstotliwości : SCE- HSQC , E.COSY i eksperymenty z selektywnością stanu spinu
Biologia strukturalna
Pomiar RDC dostarcza informacji o globalnym fałdowaniu białka lub kompleksu białkowego. W przeciwieństwie do tradycyjnych oznaczeń struktury NMR opartych na NOE , RDC dostarczają informacji strukturalnych na duże odległości. Dostarcza również informacji o dynamice cząsteczek w skalach czasowych wolniejszych niż nanosekundy.
Badania struktury biomolekularnej
Większość badań NMR struktury białek opiera się na analizie efektu jądrowego Overhausera , NOE, między różnymi protonami w białku. Ponieważ NOE zależy od odwróconej szóstej potęgi odległości między jądrami, r -6 , NOE można przekształcić w ograniczenia odległości, które można wykorzystać w obliczeniach struktury typu dynamiki molekularnej . RDC zapewniają ograniczenia orientacyjne, a nie odległościowe, i mają kilka zalet w porównaniu z NOE:
- RDC dostarczają informacji o kącie względem zewnętrznego pola magnetycznego, co oznacza, że mogą dostarczać informacji o względnej orientacji części cząsteczki, które są daleko od siebie w strukturze.
- W dużych cząsteczkach (>25kDa) często trudno jest zarejestrować NOE ze względu na dyfuzję spinu . To nie jest problem z RDC.
- Analiza dużej liczby NOE może być bardzo czasochłonna.
Pod warunkiem, że dostępny jest bardzo kompletny zestaw RDC, wykazano dla kilku systemów modelowych, że struktury molekularne można obliczyć wyłącznie na podstawie tych interakcji anizotropowych, bez uciekania się do ograniczeń NOE. Jednak w praktyce jest to nieosiągalne i RDC służy głównie do udoskonalenia struktury określonej przez dane NOE i sprzężenie typu J. Jednym z problemów związanych ze stosowaniem sprzężeń dipolarnych do określania struktury jest to, że sprzężenie dipolarne nie opisuje jednoznacznie orientacji wektora międzyjądrowego. Co więcej, jeśli dostępny jest bardzo mały zestaw sprzężeń dipolarnych, udoskonalenie może prowadzić do struktury gorszej niż oryginalna. W przypadku białka z N aminokwasami ograniczenie 2N RDC dla szkieletu jest minimum potrzebnym do dokładnego udoskonalenia.
Treść informacyjną pojedynczego pomiaru RDC dla określonego wektora wiązań (takiego jak określone wiązanie NH szkieletu w cząsteczce białka) można zrozumieć, pokazując krzywą docelową, która wyznacza kierunki idealnej zgodności między obserwowaną wartością RDC a wartością obliczoną od modelu. Taka krzywa (patrz rysunek) ma dwie symetryczne gałęzie, które leżą na kuli, której oś biegunowa jest zgodna z kierunkiem pola magnetycznego. Ich wysokość od równika kuli zależy od wielkości wartości RDC, a ich kształt od „rombowości” (asymetrii) tensora wyrównania molekularnego. Gdyby wyrównanie molekularne było całkowicie symetryczne wokół kierunku pola magnetycznego, krzywa docelowa składałaby się po prostu z dwóch okręgów ustawionych pod tym samym kątem od biegunów co kąt , jaki określony wektor wiązania tworzy z przyłożonym polem magnetycznym.
W przypadku wydłużonych cząsteczek, takich jak RNA , gdzie informacje o skręcaniu lokalnym i krótkie odległości nie wystarczają do ograniczenia struktur, pomiary RDC mogą dostarczyć informacji o orientacji określonych wiązań chemicznych w całym kwasie nukleinowym w odniesieniu do pojedynczej ramki współrzędnych. W szczególności cząsteczki RNA są protony , a nakładanie się rezonansów rybozy bardzo utrudnia wykorzystanie danych sprzężenia J i danych NOE do określenia struktury. Ponadto można wykryć RDC między jądrami w odległości większej niż 5-6 Å. Ta odległość jest zbyt duża do wygenerowania sygnału NOE. Dzieje się tak, ponieważ RDC jest proporcjonalne do r −3 podczas gdy NOE jest proporcjonalne do r −6 .
Pomiary RDC okazały się również niezwykle przydatne do szybkiego określania względnych orientacji jednostek znanych struktur w białkach. Zasadniczo orientację podjednostki strukturalnej, która może być tak mała jak obrót helisy lub tak duża jak cała domena, można ustalić na podstawie zaledwie pięciu RDC na podjednostkę.
Dynamika białek
Ponieważ RDC dostarcza uśrednionych przestrzennie i czasowo informacji o kącie między zewnętrznym polem magnetycznym a wektorem wiązań w cząsteczce, może dostarczać bogatych informacji geometrycznych o dynamice w wolnej skali czasowej (> 10-9 s) w białkach. W szczególności, ze względu na swoją radialną zależność, RDC jest szczególnie wrażliwy na procesy kątowe o dużej amplitudzie. Wczesny przykład Tolmana i in. stwierdzili, że wcześniej opublikowane struktury mioglobiny były niewystarczające do wyjaśnienia zmierzonych danych RDC i opracowali prosty model powolnej dynamiki, aby temu zaradzić. Jednak dla wielu klas białek, w tym wewnętrznie nieuporządkowanych białek , analiza RDC staje się bardziej zaangażowana, ponieważ zdefiniowanie ramki wyrównania nie jest trywialne. Dwa niedawne artykuły opisują obiecujące rozwiązanie problemu poprzez obejście konieczności wyraźnego zdefiniowania ramy wyrównania.
Zobacz też
- Magnetyczne oddziaływanie dipol-dipol
- Resztkowa anizotropia przesunięcia chemicznego (rCSA)
- Jądrowy rezonans magnetyczny ciała stałego (ssNMR)
Dalsza lektura
Książki :
- Emsley, JW; Lindon, JC NMR Spektroskopia z użyciem rozpuszczalników ciekłokrystalicznych; Pergamon Press: Oxford, Wielka Brytania, 1975.
Artykuły przeglądowe :
- Ad Bax i Alexander Grishaev, Current Opinion in Structural Biology , 15:563–570 (2005)
- Rebecca S. Lipsitz i Nico Tjandra, Annu. Wielebny Biophys. Biomol. Struktura . 33:387-413 (2004)
Klasyczne papiery :
- Saupe, A.; Englert, G. (1963). „Widma magnetycznego rezonansu jądrowego o wysokiej rozdzielczości zorientowanych cząsteczek”. Fizyczne listy przeglądowe . 11 (10): 462–464. Bibcode : 1963PhRvL..11..462S . doi : 10.1103/physrevlett.11.462 .
- Saupe, A (1964). "Kernresonanzen w kristallinen Flüssigkeiten und w kristallinflüssigen Lösungen. Teil I" . Zeitschrift für Naturforschung . 19a (2): 161–171. Bibcode : 1964ZNatA..19..161S . doi : 10.1515/zna-1964-0201 . S2CID 94943333 .
- Deloche, B.; Samulski, ET (1981). „Porządek orientacyjny podobny do nematycznego krótkiego zasięgu w naprężonych elastomerach: badanie rezonansu magnetycznego deuteru”. makrocząsteczki . 14 (3): 575–581. Bibcode : 1981MaMol..14..575D . doi : 10.1021/ma50004a024 .
- Tjandra, Nico; Bax, reklama (1997). „Bezpośredni pomiar odległości i kątów w biomolekułach metodą NMR w rozcieńczonym ośrodku ciekłokrystalicznym”. nauka . 278 (5340): 1111–1114. Bibcode : 1997Sci...278.1111T . doi : 10.1126/science.278.5340.1111 . PMID 9353189 .
- Tjandra, N.; Omichiński, JG; Gronenborn AM; Clore, GM; Bax, A. (1997). „Zastosowanie sprzężeń dipolarnych 1H – 15N i 1H – 13C do wyznaczania struktury magnetycznie zorientowanych makrocząsteczek w roztworze”. Biologia strukturalna przyrody . 4 (9): 732–738. doi : 10.1038/nsb0997-732 . PMID 9303001 . S2CID 22357937 .
- Tjandra, N.; Bax, A. (1997). „Pomiar wkładu dipolarnego w rozszczepienia 1JCH z zależności modulacji J od pola magnetycznego w dwuwymiarowych widmach NMR”. J. Magn. Rezon . 124 (2): 512–515. Bibcode : 1997JMagR.124..512T . doi : 10.1006/jmre.1996.1088 . PMID 9169226 .
- Tolman, JR; i in. (1997). „Dowody NMR na powolne kolektywne ruchy cyjanometmioglobiny”. Biologia strukturalna przyrody . 4 (4): 292–297. doi : 10.1038/nsb0497-292 . PMID 9095197 . S2CID 29605996 .
- Tolman, JR; Prestegard, JH (1996). „Ilościowy eksperyment z korelacją J w celu dokładnego pomiaru sprzężeń amidu 15N – 1H z jednym wiązaniem w białkach” . J. Magn. Rezon. B. _ 112 (3): 245–252. Bibcode : 1996JMRB..112..245T . doi : 10.1006/jmrb.1996.0138 . PMID 8921605 .
- Tolman, JR; Flanagan, JM; Kennedy, MA; Prestegard, JH (1995). „Oddziaływania magnetycznych dipoli jądrowych w białkach zorientowanych na pole: informacje do określania struktury w roztworze” . proc. Natl. Acad. nauka USA . 92 (20): 9279–9283. Bibcode : 1995PNAS...92.9279T . doi : 10.1073/pnas.92.20.9279 . PMC40968 . _ PMID 7568117 .
- Clore, GM (2000). „Dokładne i szybkie dokowanie kompleksów białko-białko na podstawie międzycząsteczkowych jądrowych danych wzmocnienia Overhausera i sprzężeń dipolarnych poprzez minimalizację brył sztywnych” . proc. Natl. Acad. nauka USA . 97 (16): 9021–9025. Bibcode : 2000PNAS...97.9021C . doi : 10.1073/pnas.97.16.9021 . PMC 16814 . PMID 10922057 .
- Sanders, CR; Zając, BJ; Howard, KP; Prestegard, JH (1994). „Magnetycznie zorientowane micele fosfolipidowe jako narzędzie do badania cząsteczek związanych z błoną” . Wałówka. jądrowy Magn. Rezon. Spektrosc . 26 : 421–444. doi : 10.1016/0079-6565(94)80012-x .
- Bastiaan, EW; Maclean, C.; Van Zijl, PCM; Bothner-By, AA (1987). „Wysokiej rozdzielczości NMR cieczy i gazów: wpływ wyrównania molekularnego indukowanego polem magnetycznym”. rok Przedstawiciel NMR Spectrosc . Roczne raporty dotyczące spektroskopii NMR. 19 : 35–77. doi : 10.1016/s0066-4103(08)60245-8 . ISBN 9780125053198 .



}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64cb9a1de4ac67a4d920322838be224b4330f0b2)








![H_{{\mathrm {D}}}=D_{{IS}}(\theta )[2I_{z}S_{z}-(I_{x}S_{x}+I_{y}S_{y})]\!](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1ef53aaf415fafa421f740336087b2fe905859d)
![{\displaystyle D_{IS}(\theta )={\frac {\hbar ^{2}\gamma _{I}\gamma _{S}}{4\pi r_{IS}^{3}}}[1-3\cos ^{2}\theta ].\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5304d624d47f35b40cf0fcb7e7cb645a5339c377)



