miedzian
Miedzian luźno odnosi się do materiału, który można postrzegać jako zawierający anionowe kompleksy miedzi . Przykłady obejmują tetrachloridomiedzian ([CuCl 4 ] 2− ), nadprzewodnik YBa 2 Cu 3 O 7 i związki miedzioorganiczne (np. dimetylomiedzian [Cu(CH 3 ) 2 ] − ). Termin miedziany pochodzi od łacińskiego słowa oznaczającego miedź, cuprum . Termin ten jest używany głównie w trzech kontekstach: materiały tlenkowe , anionowe kompleksy koordynacyjne i anionowe związki miedzioorganiczne .
tlenki
Jednym z najprostszych miedzianów na bazie tlenków jest tlenek miedzi(III) KCuO 2 , znany również jako „miedzian(III) potasu”. Gatunek ten można postrzegać jako sól K + polianionu [ CuO
- 2 ] n . Jako taki materiał jest klasyfikowany jako miedzian. To ciemnoniebieskie diamagnetyczne ciało stałe jest wytwarzane przez ogrzewanie nadtlenku potasu i tlenku miedzi (II) w atmosferze tlenu:
- K 2 O 2 + 2 CuO → 2 KCuO 2
Znane są inne miedziany (III) metali alkalicznych; dodatkowo określono również strukturę KCuO 2 , RbCuO 2 i CsCuO 2 .
KCuO 2 jako pierwsi odkryli w 1952 roku VK Wahl i W. Klemm, którzy zsyntetyzowali ten związek przez ogrzewanie tlenku miedzi(II) i nadtlenku potasu w atmosferze tlenu.
- 2KO2 + 2CuO → KCuO2 + O2
Można go również zsyntetyzować przez ogrzewanie ponadtlenku potasu i proszku miedzi:
- KO2 + Cu → KCuO2
KCuO 2 reaguje z powietrzem dość wolno. Zaczyna się rozkładać przy 760K, a jego kolor zmienia się z niebieskiego na bladozielony przy 975K. Jego temperatura topnienia wynosi 1025 K.
RbCuO 2 (niebiesko-czarny) i CsCuO 2 (czarny) można otrzymać w reakcji tlenku rubidu i tlenku cezu z proszkami tlenku miedzi(II), odpowiednio w temperaturze 675K i 655K w atmosferze tlenu. Każdy z nich szybko reaguje z powietrzem, w przeciwieństwie do KCuO 2 .
W rzeczywistości KCuO 2 jest związkiem niestechiometrycznym, więc dokładniejszy wzór to KCuO x i x jest bardzo bliski 2. Powoduje to powstawanie defektów w strukturze krystalicznej, a to prowadzi do tendencji tego związku do zredukowany.
Miedzian sodu(III) NaCuO 2 można wytworzyć przy użyciu podchlorynów lub podbromitów do utleniania wodorotlenku miedzi w warunkach zasadowych iw niskiej temperaturze.
- 2NaOH + CuSO 4 → Cu(OH) 2 ↓
- Cu(OH) 2 + 2NaOH + NaClO → 2NaCuO 2 + NaCl + H
2 O
Miedziany (III) nie są stabilne w wodzie i mogą również utleniać wodę.
- 4 CuO
- 2 + 2 H
2 O → 4 CuO + O
2 ↑ + 4 OH -
Miedziany(III) sodu mają czerwonawo-brązową barwę i stopniowo stają się czarne, ponieważ rozkładają się do tlenku miedzi(II) . Aby zapobiec ich rozkładowi, muszą być produkowane w niskiej temperaturze i bez dostępu światła. [ potrzebne źródło ]
Kompleksy koordynacyjne
Miedź tworzy wiele anionowych kompleksów koordynacyjnych z ujemnie naładowanymi ligandami, takimi jak cyjanki, wodorotlenki, halogenki, a także alkile i aryle.
Miedź(I)
Miedziany zawierające miedź(I) są zwykle bezbarwne, co odzwierciedla ich konfigurację d10 . Struktury wahają się od liniowych o 2 współrzędnych, płaskich trygonalnych i czworościennych. Przykładami są dichloro i trichloromiedziany, tj. liniowe [CuCl 2 ] − i trygonalne płaskie [CuCl 3 ] 2− . Cyjanek daje analogiczne kompleksy, ale także trianionowy tetracyjanomiedzian(I), [Cu(CN) 4 ] 3− . Dicyjanomiedzian (I) występuje zarówno w motywach molekularnych, jak i polimerowych, w zależności od przeciwkationu.
Miedź(II)
Chloromiedzian obejmuje trichloromiedzian(II) [CuCl 3 ] − , który jest dimerem, kwadratowy tetrachloromiedź(II) [CuCl 4 ] 2− i pentachloromiedź(II) [CuCl 5 ] 3− . Kompleksy 3-koordynacyjne chloromiedzianu (II) są rzadkie.
Kompleksy tetrachloromiedzianu (II) mają tendencję do przyjmowania spłaszczonej geometrii czworościennej z pomarańczowymi kolorami.
Przykładem homoleptycznego (wszystkie ligandy są takie same) kompleksu wodorotlenkowego jest tetrahydroksymiedzian sodu (Na 2 [Cu(OH) 4 ]).
- Cu (OH) 2 + 2 NaOH → Na 2 Cu (OH) 4
Miedź(III) i miedź(IV)
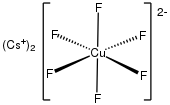
Heksafluoromiedzian(III) [CuF 6 ] 3− i heksafluoromiedzian(IV) [CuF 6 ] 2− to rzadkie przykłady kompleksów miedzi(III) i miedzi(IV). Są silnymi utleniaczami .
Organiczne miedziany
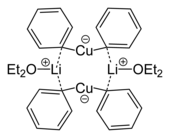
Miedziany odgrywają rolę w syntezie organicznej . Są to niezmiennie Cu (I), chociaż w niektórych mechanizmach przywołuje się związki pośrednie Cu (II), a nawet Cu (III). Organiczne miedziany często mają wyidealizowane wzory [CuR 2 ] − i [CuR 3 ] 2− , gdzie R oznacza alkil lub aryl. Odczynniki te znajdują zastosowanie jako nukleofilowe odczynniki alkilujące .