poliselenek
W chemii poliselenek zwykle odnosi się do anionów o wzorze (Sen ) 2- , gdzie Se jest atomowym symbolem pierwiastka selenu . Wiele grup głównych i metali przejściowych tworzy kompleksy z anionami poliselenowymi.
Przygotowanie
Koncepcyjnie poliselenidy powstają w wyniku deprotonowania poliselenanów H 2 Se n , ale takie gatunki są rzadkie lub niestabilne. Zamiast tego analogicznie do przygotowania wielu jonów Zintla , poliselenki są wytwarzane przez redukcję elementarnego Se metalami alkalicznymi. Takie reakcje można prowadzić ogrzewając mieszaninę ciał stałych lub rozpuszczając metal Se w aminowych roztworach metali alkalicznych. Syntezę można również prowadzić w wysokowrzących, polarnych, aprotonowych rozpuszczalnikach, takich jak DMF, HMPA i NMP. Wydaje się, że reakcje te przebiegają przez początkowe tworzenie selenku metalu alkalicznego, po którym następuje reakcja tego ostatniego z dodatkowym selenem:
- 2 Na + Se → Na 2 Se
- Na 2 Se + n Se → Na 2 Se n +1
Po wytworzeniu poliselenki metali alkalicznych można przekształcić w sole lipofilowe przez traktowanie ligandami kryptandowymi lub przez wymianę jonową solami czwartorzędowymi .
- Na 2 Se n + 2 R 4 NCl → (R 4 N) 2 Se n + 2 NaCl
Struktury
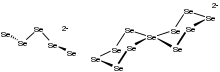
Sole poliselenków często charakteryzowano za pomocą krystalografii rentgenowskiej . Sole poliselenków na ogół mają otwarte łańcuchy, które przyjmują konformację zygzakowatą. W rzadkich przypadkach obserwuje się struktury cykliczne, jak w przypadku Li 2 Se 5 , w którym znajduje się kwadratowo-płaszczyznowe centrum Se. Widma 77 Se NMR w stanie stałym o wysokiej rozdzielczości [NMe4 ] 2Se6 wykazują trzy miejsca selenu. Określenie struktury rentgenowskiej monokryształu dwóch soli potwierdza dane NMR.
Reaktywność
Poliselenidy są podatne na rozkład pod wpływem powietrza, w którym to przypadku są ponownie utleniane do pierwiastkowego selenu.
-
Se
2− n + 2 H. + + 1 ⁄ 2 O 2 → n Se + H. 2 O
Jako ligandy w kompleksach koordynacyjnych poliselenidy są na ogół dwukleszczowe. Znane są kompleksy ligandów penta-, tetra- i triselenkowych. Jednym z przykładów jest spirocykliczny [Zn( Se4 ) 2 ] 2- .
Dalsza lektura
- Graf, chrześcijanin; Assud, Abdeljalil; Mayasree, Oottil; Kleinke, Holger (2009). „Stałe poliselenidy i politellurydy: duża różnorodność interakcji Se – Se i Te – Te” . Cząsteczki . 14 (9): 3115–3131. doi : 10,3390/cząsteczki14093115 . PMC 6255372 . PMID 19783911 .
- Sheldrick, William S. (2012). „Aniony polichalkogenków: różnorodność strukturalna i wszechstronność ligandów”. Zeitschrift für Anorganische und Allgemeine Chemie . 638 (15): 2401–2424. doi : 10.1002/zaac.201200241 .
Zobacz też
- ^ Greenwood, Norman N .; Earnshaw, Alan (1997). Chemia pierwiastków (wyd. 2). Butterwortha-Heinemanna . P. 763-765. ISBN 978-0-08-037941-8 .
- Bibliografia _ Boudjouk, PA (1988). „Wygodna synteza selenków i diselenków metali alkalicznych w tetrahydrofuranie oraz różnice w reaktywności wykazywane przez te sole w stosunku do bromków organicznych”. Journal of Chemii Organicznej . 53 : 2109-2112. doi : 10.1021/jo00244a051 .
- ^ Kolis, J. „Chemia koordynacyjna anionów polichalkogenu i karbonylków metali przejściowych” Recenzje chemii koordynacyjnej 1990, tom 105, s. 195-219. doi : 10.1016/0010-8545(90)80023-M
- Bibliografia _ Clark, RJH; Selenowa spektroskopia NMR w stanie stałym i struktury kompleksów pentaseleniku i heksaselenu tetrametyloamoniowego. Inorg. Chem, 1995, 34, 4299–4304 DOI: 10.1021/ic00121a006
- ^ Kanatzidis, Mercouri G. (1990). „Rozpuszczalne polichalkogenidy późnej przemiany i elementy grupy głównej”. Komentarze na temat chemii nieorganicznej . 10 (4–5): 161–195. doi : 10.1080/02603599008048650 .