łańcuch J
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| JCHAIN | |||||||||||||||||||||||||||||||||||||||||||||||
| , łańcuch IGCJ, JCH, IGJ, J, łańcuch łączący multimeryczne | |||||||||||||||||||||||||||||||||||||||||||||||
| identyfikatory zewnętrzne IgA i IgM | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
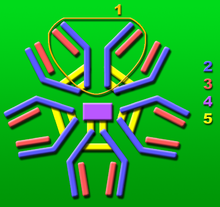
Pentameryczna cząsteczka przeciwciała immunoglobuliny M (IgM) (składająca się z pięciu jednostek podstawowych). 1: Jednostka podstawowa. 2: Ciężkie łańcuchy . 3: Łańcuchy lekkie . 4 : łańcuch J. 5: Międzycząsteczkowe wiązania dwusiarczkowe.

Łańcuch J jest białkowym składnikiem przeciwciał IgM i IgA . Jest to polipeptyd o długości 137 reszt , kodowany przez gen IGJ .
Struktura
Łańcuch J jest glikoproteiną o masie cząsteczkowej 15 kDa. Jego drugorzędowa struktura pozostaje nieokreślona, ale uważa się, że przyjmuje albo pojedynczą beczkę β , albo złożoną strukturę dwudomenową ze standardowymi domenami immunoglobulinowymi. Pierwszorzędowa struktura łańcucha J jest niezwykle kwaśna i ma wysoką zawartość ujemnie naładowanych aminokwasów. Ma 8 cysteiny , z których 6 bierze udział w wewnątrzcząsteczkowych wiązaniach dwusiarczkowych, podczas gdy pozostałe dwie wiążą regiony końcówek Fc przeciwciał IgA lub IgM , łańcuch α i łańcuch μ odpowiednio. N-połączony węglowodan powstały w wyniku N-glikozylacji jest również niezbędny we włączaniu białka do polimerów przeciwciał. Nie ma znanej rodziny białek o znaczącej homologii z łańcuchem J.
Funkcjonować
Polimeryzacja przeciwciał
Łańcuch J reguluje multimeryzację IgM i IgA u ssaków. Gdy ulega ekspresji w komórkach, sprzyja tworzeniu pentamerycznej IgM i dimeru IgA. Pentamery IgM są najczęściej spotykane z pojedynczym łańcuchem J, ale niektóre badania wykazały aż 4 równoważniki stechiometryczne.
Łańcuch J jest włączany późno w tworzenie polimerów IgM i termodynamicznie sprzyja tworzeniu pentamerów w przeciwieństwie do heksamerów. U myszy z łańcuchem J dominuje heksameryczny polimer IgM. Te heksamery IgM z ujemnym łańcuchem J są 15-20 razy skuteczniejsze w aktywacji dopełniacza niż pentamery IgM z dodatnim łańcuchem J. Jednak wykazano, że myszy z łańcuchem J mają niskie stężenia heksamerycznej IgM i niedobór aktywacji dopełniacza, co sugeruje dodatkowe in vivo mechanizmy regulacyjne. Inną konsekwencją ograniczonej aktywacji dopełniacza przez pentameryczną IgM jest umożliwienie pIgM pozytywnej łańcucha J na wiązanie antygenu bez powodowania nadmiernego uszkodzenia błon nabłonkowych poprzez aktywację dopełniacza.
Łańcuch J ułatwia dimeryzację IgA poprzez połączenie dwóch wydzielniczych ogonów monomeru. Strukturalnie łańcuch J łączy asymetrycznie dwa monomery przeciwciała, tworząc międzycząsteczkowe wiązania dwusiarczkowe i tworząc hydrofobowe β-kanapki na każdej cząsteczce razem. Ten mechanizm multimeryzacji obejmuje białka opiekuńcze, w tym wiążące białko immunoglobuliny (BiP) i MZB1 , z których każde sekwencyjnie rekrutuje odrębne czynniki spolimeryzowanego przeciwciała.
Wydzielanie przeciwciał
Wydzielanie przeciwciał błony śluzowej z komórek nabłonka podstawnego do wierzchołkowego jest ułatwione przez polimeryczny receptor Ig (pIgR). Podstawowe białko pIgR, znane jako składnik wydzielniczy (SC), rozpoznaje Ig gotowe do wydzielenia. Wiązanie między składnikiem wydzielniczym a wydzielniczą Ig jest ułatwione przez łańcuch J przeciwciała, który wchodzi w fizyczny kontakt ze składnikiem wydzielniczym w celu zmiany konformacji transportera do stanu otwartego. Kompleks jest następnie poddawany transcytozie oraz składnik wydzielniczy odcięty proteolitycznie od receptora, uwalniając przeciwciało w wierzchołkowej stronie komórki nabłonkowej iw całym świetle. Uważa się, że mechanizm ten jest w dużej mierze zachowany między wydzielaniem IgM i IgA.
Rozporządzenie
Pierwotnie uważano, że łańcuch J ulega ekspresji tylko w komórkach plazmatycznych wydzielających przeciwciała, jednak zaobserwowano, że łańcuch J ulega ekspresji na wcześniejszych etapach różnicowania komórek B przed ekspresją Ig. Uważa się, że ekspresja łańcucha J zachodzi we wczesnych stadiach różnicowania komórek limfoidalnych , ponieważ ulega ekspresji zarówno w prekursorach komórek B, jak i T. Wydaje się, że w miarę rozwoju komórek ekspresja łańcucha μ staje się niezbędna do syntezy łańcucha J.
Gen łańcucha J jest regulowany transkrypcyjnie przez kanoniczną represję Pax5 . Ponieważ Pax5 jest powszechnym regulatorem transkrypcji, łańcuch J jest nadal wyrażany w komórkach plazmatycznych, które wydzielają monomeryczne przeciwciała. Uważa się, że w takich komórkach nie pełni żadnej funkcji i szybko ulega degradacji. W komórkach plazmatycznych, które wydzielają monomeryczną IgA, mechanizm niezależny od Pax5 prawdopodobnie zapobiega dimeryzacji IgA.
Filogeneza
Łańcuch J prawdopodobnie powstał ewolucyjnie u wczesnych kręgowców o kości szczękowej. Od tego czasu grupy ryb kostnoszkieletowych, w tym teleoste, utraciły ekspresję łańcucha J. Xenopus są zdolne do polimeryzacji śluzówkowej IgX pod nieobecność łańcucha J, być może z powodu utraty konserwatywnych reszt cysteiny, które łączą łańcuch J i ogon wydzielniczy Ig.
Rekiny nie wykazują ekspresji IgA i dlatego wykorzystują ekspresję łańcucha J wyłącznie do polimeryzacji IgM. To sprawia, że rekiny są intrygującym organizmem modelowym w badaniu regulacji łańcucha J i polimeryzacji bez zakłócających zmiennych wydzielania śluzówki.
Dalsza lektura
- Koshland ME (1986). „Dojrzewanie łańcucha J immunoglobuliny”. Roczny przegląd immunologii . 3 : 425–453. doi : 10.1146/annurev.iy.03.040185.002233 . PMID 2415140 .
- Tartakoff A, Vassalli P (listopad 1979). „Cząsteczki immunoglobuliny M komórek plazmatycznych. Ich biosynteza, składanie i transport wewnątrzkomórkowy” . Journal of Cell Biology . 83 (2 Pt 1): 284–299. doi : 10.1083/jcb.83.2.284 . PMC 2111544 . PMID 115892 .
- Kret JE, Bhown AS, Bennett JC (sierpień 1977). „Pierwotna struktura ludzkiego łańcucha J: wyrównanie peptydów z hydroliz chemicznych i enzymatycznych”. Biochemia . 16 (16): 3507–3513. doi : 10.1021/bi00635a002 . PMID 407930 .
- Bastian A, Kratzin H, Eckart K, Hilschmann N (grudzień 1992). „Wewnątrzłańcuchowe i międzyłańcuchowe mostki dwusiarczkowe ludzkiego łańcucha J w wydzielniczej immunoglobulinie A”. Chemia biologiczna Hoppe-Seyler . 373 (12): 1255-1263. doi : 10.1515/bchm3.1992.373.2.1255 . PMID 1292512 .
- Frutiger S, Hughes GJ, Paquet N, Lüthy R, Jaton JC (grudzień 1992). „Przypisanie wiązania dwusiarczkowego w ludzkim łańcuchu J i jego kowalencyjne parowanie z immunoglobuliną M”. Biochemia . 31 (50): 12643–12647. doi : 10.1021/bi00165a014 . PMID 1472500 .
- Moro I, Iwase T, Komiyama K, Moldoveanu Z, Mestecky J (kwiecień 1990). „Miejsca polimeryzacji immunoglobuliny A (IgA) w ludzkich immunocytach: badanie mikroskopowe immunoelektronów” . Struktura i funkcja komórki . 15 (2): 85–91. doi : 10.1247/csf.15.85 . PMID 2113434 .
- Alberini CM, Bet P, Milstein C, Sitia R (październik 1990). „Wydzielanie półproduktów składania immunoglobulin M w obecności czynników redukujących”. Natura . 347 (6292): 485–487. Bibcode : 1990Natur.347..485A . doi : 10.1038/347485a0 . PMID 2120591 . S2CID 4348113 .
- Sumi Y, Nagura H, Kaneda T, Oka T (wrzesień 1988). „Immunoelektronowa mikroskopowa lokalizacja immunoglobulin, składnika wydzielniczego i łańcucha J w mniejszych gruczołach ślinowych człowieka”. Dziennik patologii jamy ustnej . 17 (8): 390–395. doi : 10.1111/j.1600-0714.1988.tb01303.x . PMID 3146624 .
- Hajdu I, Moldoveanu Z, Cooper MD, Mestecky J (grudzień 1983). „Badania ultrastrukturalne ludzkich komórek limfoidalnych. Ekspresja łańcuchów mu i J jako funkcja różnicowania komórek B” . The Journal of Experimental Medicine . 158 (6): 1993–2006. doi : 10.1084/jem.158.6.1993 . PMC 2187181 . PMID 6417260 .
- Yasuda N, Kanoh T, Uchino H (czerwiec 1980). „Synteza łańcucha J w ludzkich komórkach szpiczaka: badania mikroskopowe świetlne i elektronowe” . Immunologia kliniczna i eksperymentalna . 40 (3): 573–580. PMC 1538946 . PMID 6774844 .
- Harper SJ, Allen AC, Béné MC, Pringle JH, Faure G, Lauder I, Feehally J (wrzesień 1995). „Zwiększone dimeryczne komórki B wytwarzające IgA w migdałkach w nefropatii IgA określone przez hybrydyzację in situ dla mRNA łańcucha J” . Immunologia kliniczna i eksperymentalna . 101 (3): 442–448. doi : 10.1111/j.1365-2249.1995.tb03132.x . PMC 1553245 . PMID 7664491 .
- Iwase T, Saito I, Takahashi T, Chu L, Usami T, Mestecky J, Moro I (październik 1993). „Wczesna ekspresja ludzkiego łańcucha J i genu łańcucha mu w wątrobie płodu” . Struktura i funkcja komórki . 18 (5): 297–302. doi : 10.1247/csf.18.297 . PMID 8168154 .
- Harper SJ, Pringle JH, Wicks AC, Hattersley J, Layward L, Allen A i in. (marzec 1994). „Ekspresja mRNA łańcucha J w komórkach plazmatycznych IgA dwunastnicy w nefropatii IgA” . Międzynarodowa Nerka . 45 (3): 836–844. doi : 10.1038/ki.1994.110 . PMID 8196286 .
- Bjercke S, Brandtzaeg P (wrzesień 1993). „Dystrybucja gruczołowa immunoglobulin, łańcucha J, składnika wydzielniczego i HLA-DR w ludzkim endometrium w całym cyklu menstruacyjnym”. Rozmnażanie człowieka . 8 (9): 1420–1425. doi : 10.1093/oxfordjournals.humrep.a138271 . PMID 8253928 .
- Bertrand FE, Billips LG, Gartland GL, Kubagawa H, Schroeder HW (czerwiec 1996). „Gen łańcucha J jest transkrybowany podczas limfopoezy B i T u ludzi”. Journal of Immunology . 156 (11): 4240–4244. doi : 10.4049/jimmunol.156.11.4240 . PMID 8666793 . S2CID 44655675 .
- Atkin JD, Pleass RJ, Owens RJ, Woof JM (lipiec 1996). „Mutageneza końcówki łańcucha ciężkiego ludzkiej IgA1, która zapobiega składaniu dimeru”. Journal of Immunology . 157 (1): 156–159. doi : 10.4049/jimmunol.157.1.156 . PMID 8683109 . S2CID 26899100 .