Biogeneza rybosomów
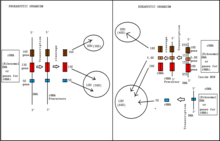
Biogeneza rybosomów to proces tworzenia rybosomów . U prokariontów proces ten zachodzi w cytoplazmie z transkrypcją wielu operonów genów rybosomów . U eukariontów zachodzi zarówno w cytoplazmie , jak iw jąderku . Obejmuje skoordynowaną funkcję ponad 200 białek w syntezie i przetwarzaniu trzech prokariotycznych lub czterech eukariotycznych rRNA , jak również montaż tych rRNA z białkami rybosomalnymi. Większość białek rybosomalnych należy do różnych energochłonnych rodzin enzymów, w tym helikaz RNA zależnych od ATP , AAA-ATPaz , GTPaz i kinaz . Około 60% energii komórki jest wydawane na produkcję i utrzymanie rybosomów.
Biogeneza rybosomów jest procesem ściśle regulowanym i ściśle powiązanym z innymi czynnościami komórkowymi, takimi jak wzrost i podział.
Niektórzy spekulowali, że w pochodzeniu życia biogeneza rybosomów poprzedza komórki i że geny i komórki ewoluowały w celu zwiększenia zdolności reprodukcyjnych rybosomów.
Rybosomy
Rybosomy to makrocząsteczkowe maszyny odpowiedzialne za translację mRNA na białka. Rybosom eukariotyczny, zwany także rybosomem 80S, składa się z dwóch podjednostek – dużej podjednostki 60S (która zawiera 25S [u roślin] lub 28S [u ssaków], 5,8S i 5S rRNA oraz 46 białek rybosomalnych) oraz mała podjednostka 40S (która zawiera 18S rRNA i 33 białka rybosomalne). Białka rybosomalne są kodowane przez geny rybosomalne.
| Typ | Rozmiar | Duża podjednostka ( rRNA LSU ) | Mała podjednostka ( rRNA SSU ) |
| prokariotyczny | 70S | 50S ( 5S : 120 nt, 23S : 2906 nt) | 30S ( 16S : 1542nt) |
| eukariotyczny | 80S | 60S ( 5S : 121 nt, 5,8S : 156 nt, 28S : 5070 nt) | 40S ( 18S : 1869 nt) |
Prokarionty
Istnieje 52 genów, które kodują białka rybosomalne i można je znaleźć w 20 operonach prokariotycznego DNA. Regulacja syntezy rybosomów zależy od regulacji rRNA .
Po pierwsze, zmniejszenie aminoacylo-tRNA spowoduje, że komórka prokariotyczna zareaguje poprzez obniżenie transkrypcji i translacji . Odbywa się to poprzez szereg etapów, począwszy od rygorystycznych czynników wiążących się z rybosomami i katalizujących reakcję: GTP + ATP --> pppGpp + AMP
Następnie γ-fosforan jest usuwany, a ppGpp wiąże się i hamuje polimerazę RNA. To wiązanie powoduje zmniejszenie transkrypcji rRNA. Zmniejszona ilość rRNA oznacza, że białka rybosomalne (białka r) będą podlegały translacji, ale nie będą miały rRNA, z którym mogłyby się związać. Zamiast tego będą negatywnie sprzężone zwrotnie i wiążą się z własnym mRNA, hamując syntezę r-białka. Należy zauważyć, że białka r preferencyjnie wiążą się z ich komplementarnym rRNA, jeśli jest obecny, a nie z mRNA.
Operony rybosomalne obejmują również geny polimerazy RNA i czynniki elongacyjne (stosowane w translacji RNA). Regulacja wszystkich tych genów jednocześnie ilustruje sprzężenie między transkrypcją a translacją u prokariotów.
eukarionty
Synteza białek rybosomalnych u eukariontów jest główną aktywnością metaboliczną. Występuje, podobnie jak większość syntezy białek, w cytoplazmie tuż poza jądrem. Poszczególne białka rybosomalne są syntetyzowane i importowane do jądra przez pory jądrowe . Zobacz import jądrowy , aby uzyskać więcej informacji na temat przemieszczania się białek rybosomalnych do jądra.
DNA jest transkrybowane z dużą szybkością w jąderku , które zawiera wszystkie geny 45S rRNA. Jedynym wyjątkiem jest rRNA 5S, które jest transkrybowane poza jąderkiem . Po transkrypcji rRNA łączą się z białkami rybosomalnymi, tworząc dwa rodzaje podjednostek rybosomalnych (duże i małe). Będą one później gromadzić się w cytosolu, tworząc funkcjonujący rybosom. Zobacz eksport jądrowy , aby uzyskać więcej informacji na temat przemieszczania się podjednostek rybosomu z jądra.
Przetwarzanie
Komórki eukariotyczne wspólnie dokonują transkrypcji trzech dojrzałych gatunków rRNA w szeregu etapów. Proces dojrzewania rRNA i proces rekrutacji białek r zachodzi w prekursorowych cząsteczkach rybosomalnych, czasami nazywanych prerybosomami, i odbywa się w jąderku , nukleoplazmie i cytoplazmie . Drożdże S. cerevisiae są eukariotycznym organizmem modelowym do badania biogenezy rybosomów. Biogeneza rybosomów rozpoczyna się w jąderku . Tam podjednostki 18S, 5,8S i 25S rRNA są współtranskrybowane z genów rybosomalnych jako policistronowy transkrypt przez polimerazę RNA I i jest nazywany pre-RNA 35S.
Transkrypcja polimerazy I rozpoczyna się od kompleksu inicjacyjnego Pol I, który wiąże się z promotorem rDNA . Tworzenie tego kompleksu wymaga pomocy wcześniejszego czynnika aktywującego lub UAF, który wiąże się z białkiem wiążącym TATA-box i czynnikiem rdzeniowym (CF). Razem te dwa czynniki transkrypcyjne umożliwiają kompleksowi RNA pol I wiązanie się z czynnikiem inicjującym polimerazę I, Rrn3. Gdy powstaje transkrypt pol I, około 75 małych jąderkowych rybonukleocząstek (snoRNP) ułatwia kotranskrypcyjne kowalencyjne modyfikacje > 100 reszt rRNA. Te snoRNP kontrolują metylację 2'-O-rybozy nukleotydów, a także pomagają w tworzeniu pseudourydyny . Na końcu 5' transkryptów rRNA, białka rybosomalne małych podjednostek (Rps) i czynniki nierybosomalne łączą się z transkryptami pre-RNA, tworząc kuliste gałki. Gałki te są pierwszymi cząstkami przedrybosomalnymi na szlaku małych (40S) podjednostek rybosomalnych. Transkrypt rRNA jest rozszczepiany w miejscu A2, co oddziela wczesny pre-rybosom 40S od pozostałego pre-rRNA, które połączy się z białkami rybosomalnymi dużych podjednostek (Rpl) i innymi czynnikami nierybosomalnymi, tworząc cząsteczki rybosomalne pre-60S .
podjednostka 40S
Zespół transkrypcyjny prekursora podjednostki 40 S , czasami określany jako procesom małej podjednostki (SSU) lub cząstka 90S, zachodzi w sposób hierarchiczny - zasadniczo polega na stopniowym włączaniu podkompleksów UTP-A, UTP-B i UTP-C. Te subkompleksy składają się z ponad 30 nierybosomalnych czynników białkowych, cząsteczki U3 snoRNP, kilku białek Rps i pre-rRNA 35S. Ich dokładna rola nie została jednak odkryta. Skład cząsteczki sprzed 40S zmienia się drastycznie po dokonaniu rozszczepienia w miejscach zależnych od snoRNPA U3 (miejsca A0, A1 i A2). To zdarzenie cięcia tworzy pre-rRNA 20S i powoduje dysocjację czynników rybosomalnych od cząstki pre-40S. U3 zostaje wyparte z powstającego 40S przez helikazę Dhr1. Na tym etapie procesu biogenezy rybosomu, pre-rybosom 40S wykazuje już struktury „głowy” i „ciała” dojrzałej podjednostki 40S. Pre-rybosom 40S jest transportowany z jąderka do cytoplazmy. Cytoplazmatyczny pre-rybosom 40S zawiera teraz białka rybosomalne, rRNA 20s i kilka czynników nierybosomalnych. Ostateczne utworzenie struktury „dzioba” podjednostki 40S następuje po a fosforylacji i defosforylacji z udziałem kompleksu Enp1-Ltv1-Rps3 i kinazy Hrr25. Rozszczepienie pre-rRNA 20S w miejscu D tworzy dojrzały rRNA 18s. To zdarzenie rozszczepienia zależy od kilku czynników innych niż rybosomalne, takich jak Nob1, Rio1, Rio2, Tsr1 i Fap7.
podjednostka 60S
Dojrzewanie podjednostki pre-60S do dojrzałej podjednostki 60S wymaga wielu czynników biogenezy, które łączą się i dysocjują. Ponadto niektóre czynniki składania wiążą się z podjednostką 60S, podczas gdy inne oddziałują z nią tylko przejściowo. Jako ogólny trend, dojrzewanie podjednostki sprzed 60S oznacza stopniowy spadek złożoności. Podjednostka dojrzewa w miarę przemieszczania się z jąderka do cytoplazmy i stopniowo czynniki są redukowane. Dojrzewanie podjednostki 60S wymaga pomocy około 80 czynników. Osiem z tych czynników jest bezpośrednio zaangażowanych w przetwarzanie pre-rRNA 27S A3, które w rzeczywistości kończy tworzenie dojrzałego końca 5' rRNA 5,8S. Czynniki A3 wiążą się z odległymi miejscami na pre-RNA, jak również między sobą. Następnie zbliżają do siebie obszary rRNA i promują przetwarzanie pre-rRNA oraz rekrutację białek rybosomalnych. Trzy ATPazy typu AAA usuwają czynniki z dojrzewającego pre-rybosomu 60S. Jedna z ATPaz jest białkiem Rea1 podobnym do dyneiny, składającym się z 6 różnych domen ATPazy, które tworzą strukturę pierścieniową. Struktura pierścienia jest przymocowana do elastycznego ogona, który ma końcówkę MIDAS (miejsce adhezji zależne od jonów metali). Rea1 oddziałuje z pre-rybosomem 60S poprzez swój pierścień, podczas gdy dwa substraty , Ytm1 i Rsa1, oddziałują z Rea1 poprzez końcówkę MIDAS. Rola tych substratów nie została jeszcze określona. Oba jednak, wraz z ich interakcjami, są usuwane w procesie dojrzewania pre-rybosomu 60S. Pozostałe dwie ATPazy, Rix7 i Drg1, również działają w celu usunięcia czynników składania z dojrzewającej podjednostki 60S. Helikazy i GTPazy są również zaangażowane w usuwanie czynników składania i rearanżację RNA w celu utworzenia kompletnej podjednostki 60S. Gdy znajdzie się w cytoplazmie (patrz eksport jądrowy), podjednostka 60S podlega dalszemu przetwarzaniu, aby była funkcjonalna. Reszta dużych cząstek rybosomalnych podjednostki łączy się z jednostką 60S, a pozostałe nierybosomalne czynniki składania dysocjują. W uwalnianiu czynników biogenezy pośredniczą głównie GTPazy, takie jak Lsg1 i ATPazy, takie jak Drg1. Dokładna kolejność tych wydarzeń pozostaje niejasna. Ścieżka dojrzewania cytoplazmy 60S pozostaje niekompletna w obecnym stanie wiedzy.
Eksport jądrowy
Aby jednostki prerybosomalne mogły w pełni dojrzeć, muszą zostać wyeksportowane do cytoplazmy . Aby skutecznie przejść z jąderka do cytoplazmy, pre-rybosomy wchodzą w interakcję z receptorami eksportu, aby przejść przez hydrofobowy centralny kanał kompleksu porów jądrowych. Karyoferyna Crm1 jest receptorem zarówno dla podjednostek rybosomu, jak i pośredniczy w eksporcie w sposób zależny od Ran-GTP . Rozpoznaje cząsteczki, które mają leucynę -bogate sygnały eksportu energii jądrowej. Crm1 jest przyciągany do dużej podjednostki 60S za pomocą białka adaptorowego zwanego Nmd3. Białko adaptera dla jednostki 40S jest nieznane. Oprócz Crm1, inne czynniki odgrywają rolę w eksporcie jądrowym pre-rybosomów. Ogólny receptor eksportu mRNA, zwany Mex67, jak również białko zawierające powtarzające się HEAT, Rrp12, ułatwiają eksport obu podjednostek. Czynniki te są białkami nieistotnymi i pomagają zoptymalizować eksport pre-rybosomów, ponieważ są to duże cząsteczki.
Kontrola jakości
Ponieważ rybosomy są tak złożone, pewna liczba rybosomów jest nieprawidłowo złożona i może potencjalnie marnować energię komórkową i zasoby podczas syntezy niefunkcjonalnych białek. Aby temu zapobiec, komórki mają aktywny system nadzoru, który rozpoznaje uszkodzone lub wadliwe rybosomy i kieruje je do degradacji. Mechanizm nadzoru ma na celu wykrywanie niefunkcjonalnych pre-rybosomów, jak również niefunkcjonalnych dojrzałych rybosomów. Ponadto system nadzoru zapewnia niezbędny sprzęt do degradacji i faktycznie degraduje niefunkcjonalne rybosomy. Pre-rybosomy, które gromadzą się w jądrze, są niszczone przez egzosom , który jest wielopodjednostkowym kompleksem z egzonukleazą działalność. Jeśli zdarzy się, że wadliwe podjednostki rybosomów przedostaną się z jąderka do cytoplazmy, istnieje tam drugi system nadzoru, który celuje w nieprawidłowo działające rybosomy w cytoplazmie w celu degradacji. Pewne mutacje w resztach dużej podjednostki rybosomu faktycznie spowodują rozpad RNA, a tym samym degradację jednostki. Ponieważ liczba możliwych defektów w składaniu rybosomów jest tak duża, nadal nie wiadomo, w jaki sposób system nadzoru wykrywa wszystkie defekty, ale postuluje się, że zamiast celować w określone defekty, system nadzoru rozpoznaje konsekwencje tych defektów – takie jak opóźnienia w montażu. Oznacza to, że jeśli nastąpi przerwa w składaniu lub dojrzewaniu dojrzałego rybosomu, system nadzoru będzie działał tak, jakby podjednostka była wadliwa.
Choroba człowieka
Mutacje w biogenezie rybosomów są powiązane z kilkoma ludzkimi chorobami genetycznymi rybosomopatii , w tym dziedzicznymi zespołami niewydolności szpiku kostnego, które charakteryzują się predyspozycją do raka i zmniejszoną liczbą krwinek. Rozregulowanie rybosomów może również odgrywać rolę w zaniku mięśni .
Zobacz też
- ^ A b c d e f g Kressler, Dieter; Boli, Ed; Babler, Jochen (2009). „Prowadzenie zespołu rybosomów” (PDF) . Biochimica et Biophysica Acta (BBA) - Badania nad komórkami molekularnymi . 1803 (6): 673–683. doi : 10.1016/j.bbamcr.2009.10.009 . PMID 19879902 .
- ^ Krista Conger (26 czerwca 2017). „Nowo zidentyfikowany proces regulacji genów stanowi wyzwanie dla przyjętej nauki, twierdzą naukowcy” . Wewnątrz Stanford Medicine . Tom. 9, nie. 12. Uniwersytet Stanforda.
- ^ a b c d e f g h Thomson, Emma; Ferreira-Cerca, Sebastien; Boli, Ed (2013). „Biogeneza rybosomów eukariotycznych w skrócie” . Journal of Cell Science . 126 (21): 4815–4821. doi : 10.1242/jcs.111948 . PMID 24172536 .
- ^ Lu T, Stroot PG, Oerther DB (2009). „Odwrotna transkrypcja 16S rRNA do monitorowania populacji bakterii syntetyzujących rybosomy w środowisku” . Mikrobiologia stosowana i środowiskowa . 75 (13): 4589–4598. Bibcode : 2009ApEnM..75.4589L . doi : 10.1128/AEM.02970-08 . PMC 2704851 . PMID 19395563 .
- ^ Korzeń-Bernstein, Meredith; Korzeń-Bernstein, Robert (21 lutego 2015). „Rybosom jako brakujące ogniwo w ewolucji życia” . Dziennik biologii teoretycznej . 367 : 130–158. doi : 10.1016/j.jtbi.2014.11.025 . PMID 25500179 .
- Bibliografia _ Ferreira-Cerca, S.; Boli, E. (2013). „Biogeneza rybosomów eukariotycznych w skrócie” . Journal of Cell Science . 126 (21): 4815–4821. doi : 10.1242/jcs.111948 . PMID 24172536 .
-
^
„ Rybosomalny RNA 5S Homo sapiens ” . 2018-05-24.
{{ cite journal }}: Cite journal wymaga|journal=( pomoc ) -
^
„ Rybosomalny RNA Homo sapiens 5,8S” . 2017-02-10.
{{ cite journal }}: Cite journal wymaga|journal=( pomoc ) -
^
„ Rybosomalny RNA Homo sapiens 28S” . 2017-02-04.
{{ cite journal }}: Cite journal wymaga|journal=( pomoc ) -
^
" Rybosomalny RNA Homo sapiens 18S" . 2017-02-04.
{{ cite journal }}: Cite journal wymaga|journal=( pomoc ) - ^ Lafontaine, Denis LJ (2010). „«Kosz na śmieci»na rybosomy: jak eukarionty degradują swoje rybosomy”. Trendy Biochem Sci . 35 (5): 267–77. doi : 10.1016/j.tibs.2009.12.006 . PMID 20097077 .
- Bibliografia _ Liu, X; Granneman, S; Zhu, J; Gill, M.; Papoulas, O; Marcotte, EM; Tollervey, D; Correll, CC; Johnson, AW (luty 2015). „Helikaza DEAH-box Dhr1 dysocjuje U3 od pre-rRNA, aby promować tworzenie centralnego pseudowęzła” . PLOS Biologia . 13 (2): e1002083. doi : 10.1371/journal.pbio.1002083 . PMC 4340053 . PMID 25710520 .
- ^ Connolly, Martin (2017). „miR-424-5p zmniejsza syntezę rybosomalnego RNA i białek w zaniku mięśni” . Dziennik wyniszczenia, sarkopenii i mięśni . 9 (2): 400–416. doi : 10.1002/jcsm.12266 . PMC 5879973 . PMID 29215200 .