Katenina alfa-1
| CTNNA1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
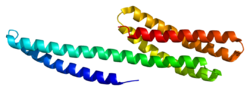 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , CAP102, Catenin, MDPT2, catenin alpha 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
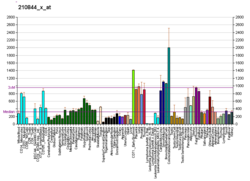
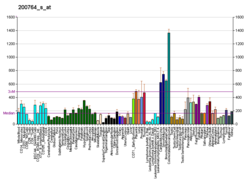
αE-katenina , znana również jako katenina alfa-1, jest białkiem , które u ludzi jest kodowane przez gen CTNNA1 . αE-katenina ulega silnej ekspresji w mięśniu sercowym i lokalizuje się w połączeniach adhezyjnych w interkalowanych strukturach dysku, gdzie pośredniczy w zakotwiczeniu włókien aktynowych w sarkolemmie . αE-katenina odgrywa również rolę w przerzutach nowotworowych i funkcji komórek skóry.
Struktura
Ludzkie białko αE-kateniny ma 100,0 kDa i 906 aminokwasów . Kateniny (α, β i γ (znane również jako plakoglobina )) zostały pierwotnie zidentyfikowane w kompleksie z E-kadheryną , białkiem adhezyjnym komórek nabłonka . αE-katenina ulega silnej ekspresji w mięśniu sercowym i jest homologiczna do białka winkuliny ; jednakże poza winkuliną , αE-katenina nie wykazuje homologii z ustalonymi białkami wiążącymi aktynę . N -koniec αE-kateniny wiąże β-kateninę lub γ-kateninę/plakoglobinę, a koniec C wiąże aktynę bezpośrednio lub pośrednio poprzez winkulinę lub α-aktyninę .
Funkcjonować
Chociaż αE-katenina wykazuje znaczną ekspresję w mięśniu sercowym , αE-katenina jest najbardziej znana z roli w przerzutach komórek nowotworowych. αE-katenina odgrywa również rolę w tkance nabłonkowej , zarówno w połączeniach przylegających , jak iw szlakach sygnałowych.
W kardiomiocytach αE-katenina jest obecna w regionach komórka-komórka zwanych połączeniami przylegającymi , które leżą w interkalowanych dyskach ; te połączenia zakotwiczają cytoszkielet aktynowy w sarkolemmie i zapewniają silną adhezję komórek.
Funkcjonalna αE-katenina jest wymagana do prawidłowego rozwoju embrionalnego, ponieważ mutacja eliminująca C-końcową 1/3 białka powodująca całkowitą utratę fenotypu funkcji wykazała przerwanie nabłonka trofoblastu i zatrzymanie rozwoju na etapie blastocysty .
W szczególności αE-katenina, a nie β- lub γ-katenina, wiąże F-aktynę oraz organizuje i wiąże włókna w obszarach kontaktu komórka-komórka. Badania pokazują, że pełnej długości αE-katenina wiąże i łączy F-aktynę w lepszy sposób w stosunku do poszczególnych domen N-końcowych lub C-końcowych .
αE-katenina wraz z β-kateniną i plakoglobiną tworzą odrębne kompleksy z N-kadheryną , które biorą udział w tworzeniu kontaktów komórka-komórka i różnicowaniu kardiomiocytów . Kompleksy katenina-N-kadheryna są najwyraźniej niezbędne do pierwszego kontaktu między komórkami i poprzedzają go, poprzedzając tworzenie połączeń szczelinowych . Zakotwiczenie kompleksów kadheryna-katenina do włókien aktynowych przez αE-kateninę jest regulowane przez fosforylację tyrozyny .
Funkcjonalny wgląd w funkcję αE-kateniny pochodzi z badań wykorzystujących transgenezę. Myszy ze dla serca delecją αE-kateniny wykazywały nieprawidłowości w wymiarach i funkcji serca, reprezentatywne dla kardiomiopatii rozstrzeniowej . Charakteryzowało się to ponadto dezorganizacją interkalowanych dysków i mitochondriów , a także kompensacyjnym wzrostem β-kateniny i spadkiem lokalizacji kadheryny i winkuliny w interkalowanych dyskach . Myszy z nokautem wykazywały również wysoką podatność na śmierć w wyniku stresu.
Znaczenie kliniczne
Interakcje
Wykazano, że αE-katenina wchodzi w interakcje z:
- APC ,
- Beta-katenina ,
- CDH1 ,
- CDH2 ,
- CDH3
- Plakoglobin i
- VE-kadheryna .
Zobacz też
Dalsza lektura
- Nagafuchi A, Takeichi M, Tsukita S (1991). „Białko związane z kadheryną 102 kD: podobieństwo do winkuliny i potranskrypcyjna regulacja ekspresji”. komórka . 65 (5): 849–57. doi : 10.1016/0092-8674(91)90392-C . PMID 1904011 . S2CID 38622586 .
- Kinch MS, Clark GJ, Der CJ, Burridge K (1995). „Fosforylacja tyrozyny reguluje zrosty nabłonka piersi przekształconego w ras” . J. Cell Biol . 130 (2): 461–71. doi : 10.1083/jcb.130.2.461 . PMC 2199929 . PMID 7542250 .
- Sacco PA, McGranahan TM, Wheelock MJ, Johnson KR (1995). „Identyfikacja domen plakoglobiny wymaganych do asocjacji z N-kadheryną i alfa-kateniną” . J. Biol. chemia . 270 (34): 20201–6. doi : 10.1074/jbc.270.34.20201 . PMID 7650039 .
- Daniel JM, Reynolds AB (1995). „Substrat kinazy tyrozynowej p120cas wiąże się bezpośrednio z E-kadheryną, ale nie z białkiem gruczolakowatej polipowatości coli lub alfa-kateniny” . Mol. Komórka. Biol . 15 (9): 4819–24. doi : 10.1128/mcb.15.9.4819 . PMC 230726 . PMID 7651399 .
- Aberle H, Butz S, Stappert J, Weissig H, Kemler R, Hoschuetzky H (1995). „Montaż kompleksu kadheryna-katenina in vitro z białkami rekombinowanymi”. J. Cell Sci . 107 (12): 3655–63. doi : 10.1242/jcs.107.12.3655 . PMID 7706414 .
- Knudsen KA, Soler AP, Johnson KR, Wheelock MJ (1995). „Interakcja alfa-aktyniny z kompleksem adhezji komórka-komórka kadheryny / kateniny poprzez alfa-kateninę” . J. Cell Biol . 130 (1): 67–77. doi : 10.1083/jcb.130.1.67 . PMC 2120515 . PMID 7790378 .
- Rimm DL, Kebriaei P, Morrow JS (1994). „Klonowanie molekularne ujawnia alternatywne formy składania ludzkiej alfa (E) -kateniny” . Biochem. Biofiza. Rez. Komuna . 203 (3): 1691-9. doi : 10.1006/bbrc.1994.2381 . PMID 7945318 .
- Oyama T, Kanai Y, Ochiai A, Akimoto S, Oda T, Yanagihara K, Nagafuchi A, Tsukita S, Shibamoto S, Ito F (1994). „Obcięta beta-katenina zakłóca interakcję między E-kadheryną i alfa-kateniną: przyczyną utraty przyczepności międzykomórkowej w ludzkich liniach komórkowych raka”. Rak Res . 54 (23): 6282–7. PMID 7954478 .
- McPherson JD, Morton RA, Ewing CM, Wasmuth JJ, Overhauser J, Nagafuchi A, Tsukita S, Isaacs WB (1994). „Przypisanie ludzkiego genu alfa-kateniny (CTNNA1) do chromosomu 5q21-q22” . Genomika . 19 (1): 188–90. doi : 10.1006/geno.1994.1042 . PMID 8188230 .
- Su LK, Vogelstein B, Kinzler KW (1994). „Związek białka supresorowego guza APC z kateninami”. nauka . 262 (5140): 1734-7. doi : 10.1126/science.8259519 . PMID 8259519 .
- Oda T, Kanai Y, Shimoyama Y, Nagafuchi A, Tsukita S, Hirohashi S (1993). „Klonowanie cDNA ludzkiej alfa-kateniny i jej nieprawidłowego mRNA w linii komórek ludzkiego raka”. Biochem. Biofiza. Rez. Komuna . 193 (3): 897–904. doi : 10.1006/bbrc.1993.1710 . PMID 8323564 .
- Furukawa Y, Nakatsuru S, Nagafuchi A, Tsukita S, Muto T, Nakamura Y, Horii A (1993). „Struktura, ekspresja i przypisanie chromosomów genu alfa 1 ludzkiej kateniny (białka związanego z kadheryną) (CTNNA1)”. Cytogenet. Genet komórkowy . 65 (1–2): 74–8. doi : 10.1159/000133603 . PMID 8404069 .
- Obama H, Ozawa M (1997). „Identyfikacja domeny alfa-kateniny zaangażowanej w jej powiązanie z beta-kateniną i plakoglobiną (gamma-katenina)” . J. Biol. chemia . 272 (17): 11017–20. doi : 10.1074/jbc.272.17.11017 . PMID 9110993 .
- Linkels M, Bussemakers MJ, Nollet F, Ewing CM, van Roy F, Schalken JA (1997). „Klonowanie molekularne alternatywnego cDNA ludzkiej alfaE-kateniny”. Biochem. Biofiza. Rez. Komuna . 237 (1): 177–81. doi : 10.1006/bbrc.1997.7058 . PMID 9266853 .
- Lewalle JM, Bajou K, Desreux J, Mareel M, Dejana E, Noël A, Foidart JM (1998). „Zmiana międzyśródbłonkowych połączeń przylegających po interakcji komórka nowotworowa-komórka śródbłonka in vitro”. Do potęgi. Rozdz . komórki 237 (2): 347–56. doi : 10.1006/excr.1997.3799 . hdl : 2268/61990 . PMID 9434630 .
- Reuver SM, Garner CC (1998). „Adhezja komórek, w której pośredniczy E-kadheryna, rekrutuje SAP97 do cytoszkieletu korowego”. J. Cell Sci . 111 (8): 1071–80. doi : 10.1242/jcs.111.8.1071 . PMID 9512503 .
- Watabe-Uchida M, Uchida N, Imamura Y, Nagafuchi A, Fujimoto K, Uemura T, Vermeulen S, van Roy F, Adamson ED, Takeichi M (1998). „Funkcje interakcji alfa-katenina-winkulina organizują wierzchołkowy kompleks łączący w komórkach nabłonka” . J. Cell Biol . 142 (3): 847–57. doi : 10.1083/jcb.142.3.847 . PMC 2148175 . PMID 9700171 .
- Roe S, Koslov ER, Rimm DL (1998). „Mutacja w alfa-kateninie zakłóca adhezję w komórkach klonu A bez zakłócania jego aktywności wiązania aktyny i beta-kateniny” . Adhezja komórkowa. Komuna . 5 (4): 283–96. doi : 10.3109/15419069809040298 . PMID 9762469 .
- Itoh M, Morita K, Tsukita S (1999). „Charakterystyka ZO-2 jako członka rodziny MAGUK związanego z ciasnymi i przylegającymi połączeniami z powinowactwem wiązania do okludyny i alfa-kateniny” . J. Biol. chemia . 274 (9): 5981–6. doi : 10.1074/jbc.274.9.5981 . PMID 10026224 .