Charakterystyka dwuwarstw lipidowych
Charakterystyka dwuwarstw lipidowych polega na wykorzystaniu różnych optycznych, chemicznych i fizycznych metod sondowania do badania właściwości dwuwarstw lipidowych. Wiele z tych technik jest skomplikowanych i wymaga drogiego sprzętu, ponieważ fundamentalna natura dwuwarstwy lipidowej sprawia, że jest to struktura bardzo trudna do zbadania. Pojedyncza dwuwarstwa, ponieważ ma zaledwie kilka nanometrów grubości, jest niewidoczna w tradycyjnej mikroskopii świetlnej. Dwuwarstwa jest również stosunkowo delikatną strukturą, ponieważ jest utrzymywana razem w całości za pomocą elementów niekowalencyjnych wiąże i ulega nieodwracalnemu zniszczeniu po wyjęciu z wody. Pomimo tych ograniczeń w ciągu ostatnich siedemdziesięciu lat opracowano dziesiątki technik umożliwiających badanie struktury i funkcji dwuwarstw. Pierwszym ogólnym podejściem było wykorzystanie nieniszczących in situ , takich jak dyfrakcja rentgenowska i opór elektryczny, które mierzą właściwości dwuwarstwy, ale w rzeczywistości nie obrazują dwuwarstwy. Później opracowano protokoły modyfikacji dwuwarstwy i umożliwienia jej bezpośredniej wizualizacji, najpierw w mikroskopie elektronowym , a ostatnio za pomocą mikroskopii fluorescencyjnej . W ciągu ostatnich dwóch dekad nowa generacja narzędzi do charakteryzacji, w tym AFM , umożliwiła bezpośrednie sondowanie i obrazowanie membran in situ z niewielkimi lub żadnymi modyfikacjami chemicznymi lub fizycznymi. Niedawno dwójłomności optycznej dwuwarstw lipidowych zastosowano interferometrię z podwójną polaryzacją w celu scharakteryzowania porządku i zakłóceń związanych z interakcjami lub efektami środowiskowymi.
Mikroskopia fluorescencyjna
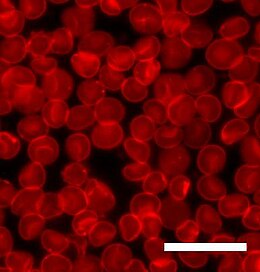
Mikroskopia fluorescencyjna jest techniką, dzięki której pewne cząsteczki mogą być wzbudzane jedną długością fali światła i emitują inną dłuższą długość fali światła. Ponieważ każda cząsteczka fluorescencyjna ma unikalne widmo absorpcji i emisji , można określić położenie poszczególnych typów cząsteczek. Naturalne lipidy nie fluoryzują, dlatego zawsze konieczne jest włączenie cząsteczki barwnika w celu zbadania dwuwarstw lipidowych za pomocą mikroskopii fluorescencyjnej. Do pewnego stopnia dodanie cząsteczki barwnika zawsze zmienia układ, aw niektórych przypadkach może być trudno stwierdzić, czy obserwowany efekt jest spowodowany lipidami, barwnikiem, czy też najczęściej ich kombinacją. Barwnik jest zwykle przyłączony do lipidu lub cząsteczki, która bardzo przypomina lipid, ale ponieważ domena barwnika jest stosunkowo duża, może zmienić zachowanie tej drugiej cząsteczki. Jest to szczególnie kontrowersyjna kwestia podczas studiowania dyfuzja lub separacja faz lipidów, ponieważ oba procesy są bardzo wrażliwe na rozmiar i kształt zaangażowanych cząsteczek.
Temu potencjalnemu powikłaniu podano argument przeciwko wykorzystaniu odzyskiwania fluorescencji po fotowybielaniu (FRAP) do określenia współczynników dyfuzji dwuwarstwowej. W typowym eksperymencie FRAP mały obszar (średnica ~ 30 µm) jest fotowybielany przez ekspozycję na intensywne źródło światła. Obszar ten jest następnie monitorowany w czasie, gdy „martwe” cząsteczki barwnika dyfundują i są zastępowane przez nienaruszone cząsteczki barwnika z otaczającej dwuwarstwy. Dopasowując tę krzywą odzysku, możliwe jest obliczenie współczynnika dyfuzji dwuwarstwy. Argumentem przeciwko stosowaniu tej techniki jest to, że tak naprawdę badana jest dyfuzja barwnika, a nie lipidów. Choć poprawne, to rozróżnienie nie zawsze jest ważne, ponieważ ruchliwość barwnika jest często zdominowana przez ruchliwość dwuwarstwy.
W tradycyjnej mikroskopii fluorescencyjnej rozdzielczość została ograniczona do około połowy długości fali użytego światła. Dzięki zastosowaniu mikroskopii konfokalnej i przetwarzania obrazu granicę tę można rozszerzyć, ale zwykle nie znacznie poniżej 100 nanometrów, czyli znacznie mniej niż typowa komórka, ale znacznie więcej niż grubość dwuwarstwy lipidowej. Niedawno zaawansowane metody mikroskopii pozwoliły w pewnych okolicznościach na znacznie większą rozdzielczość, nawet do sub-nm. Jedną z pierwszych opracowanych metod był rezonansowy transfer energii Förstera (DENERWOWAĆ). W FRET dwie cząsteczki barwnika są dobrane tak, że widmo emisyjne jednej z nich pokrywa się z widmem absorpcyjnym drugiej. Ten transfer energii jest bardzo zależny od odległości, więc z rozdzielczością angstremów można określić, jak daleko od siebie znajdują się dwa barwniki. Można to wykorzystać na przykład do określenia, kiedy dwie warstwy dwuwarstwowe ulegają stopieniu , a ich składniki mieszają się. Inną techniką mikroskopii o wysokiej rozdzielczości jest fluorescencyjna interferencyjna mikroskopia kontrastowa (FLIC). Ta metoda wymaga zamontowania próbki na precyzyjnie obrobionej mikromaszynie powierzchni odbijającej. Badając destrukcyjną interferencję Po utworzeniu wzorów możliwe jest indywidualne rozdzielenie dwóch płatków dwuwarstwy na nośniku i określenie rozkładu barwnika fluorescencyjnego w każdym z nich.
Elektryczny
Pomiary elektryczne to najprostszy sposób na scharakteryzowanie jednej z ważniejszych funkcji dwuwarstwy, a mianowicie jej zdolności do segregacji i zapobiegania przepływowi jonów w roztworze. W związku z tym charakterystyka elektryczna była jednym z pierwszych narzędzi wykorzystywanych do badania właściwości układów modelowych, takich jak czarne membrany. Wiadomo już było, że błona komórkowa jest zdolna do utrzymywania gradientu jonowego i że ten gradient odpowiada za zdolność neuronów do wysyłania sygnałów poprzez potencjał czynnościowy . Wykazanie, że podobne zjawiska mogą być replikowane in vitro była ważną weryfikacją użyteczności systemów modelowych.
Zasadniczo wszystkie pomiary elektryczne dwuwarstw obejmują umieszczenie elektrody po obu stronach membrany. Stosując napięcie polaryzacyjne na tych elektrodach i mierząc wynikowy prąd, można określić rezystancję dwuwarstwy . Ta rezystancja jest zwykle dość wysoka dla nienaruszonych dwuwarstw, często przekraczająca 100 GΩ, ponieważ hydrofobowy rdzeń jest nieprzepuszczalny dla naładowanych uwodnionych form. Ponieważ ta rezystancja jest tak duża, obecność nawet kilku dziur w skali nanometra powoduje dramatyczny wzrost prądu i można ją łatwo określić. Czułość tego systemu jest taka, że nawet aktywność pojedynczego kanały jonowe można rozwiązać. W takich pomiarach DC konieczne jest zastosowanie elektrod aktywnych elektrochemicznie, aby zapewnić niezbędne ładunki dodatnie z jednej strony i ładunki ujemne z drugiej. Najpopularniejszym systemem jest srebro/chlorek srebra, ponieważ ta reakcja jest stabilna, odwracalna, obejmuje przeniesienie pojedynczego elektronu i może generować duże prądy. Oprócz prostych pomiarów prądu stałego możliwe jest również wykonanie charakterystyki elektrycznej prądu przemiennego w celu uzyskania informacji o pojemności i złożonej impedancji dwuwarstwowego. Ponieważ pojemność jest odwrotnie proporcjonalna do grubości, a warstwy dwuwarstwowe są bardzo cienkie, zwykle mają one bardzo dużą pojemność, rzędu 2 µF/cm 2 . Pomiary pojemności są szczególnie przydatne w przypadku czarnych membran lipidowych, ponieważ można je wykorzystać do określenia, kiedy zatyczka rozpuszczalnika/lipidu zmniejsza się do pojedynczej dwuwarstwy.
Optyczny
Lipidy są wysoce polarnymi cząsteczkami , które po samodzielnym złożeniu w dwuwarstwy tworzą wysoce dwójłomną warstwę, w której właściwości optyczne równoległe są bardzo różne od tych prostopadłych. Efekt ten, badany za pomocą interferometrii z podwójną polaryzacją, został wykorzystany do pomiaru dynamicznej reorganizacji warstwy pod wpływem temperatury, siły jonowej i interakcji molekularnych, np. z peptydami przeciwbakteryjnymi.
Uwodnione dwuwarstwy wykazują bogatą dynamikę wibracyjną i są dobrymi mediami do wydajnego przenoszenia energii wibracyjnej. Właściwości wibracyjne monowarstw i dwuwarstw lipidowych badano za pomocą ultraszybkich technik spektroskopowych i niedawno opracowanych metod obliczeniowych.
AFM

Mikroskopia sił atomowych (AFM) była stosowana w ostatnich latach do obrazowania i badania właściwości fizycznych dwuwarstw lipidowych. AFM jest obiecującą techniką, ponieważ ma potencjał do obrazowania z rozdzielczością nanometrową w temperaturze pokojowej, a nawet pod wodą, w warunkach niezbędnych do naturalnego zachowania dwuwarstw. Możliwości te umożliwiły bezpośrednie obrazowanie subtelnego przejścia fazowego tętnienia w obsługiwanej warstwie dwuwarstwowej. Kolejny eksperyment AFM przeprowadzony w trybie stukania w wodnym środowisku buforowym pozwoliły (1) określić powstawanie porów (dziur) transbłonowych wokół nanocząstek o średnicy około 1,2 do 22 nm poprzez odjęcie obrazów AFM od serii zarejestrowanych podczas tworzenia dwuwarstwy lipidowej oraz (2) zaobserwować adsorpcję pojedynczej insuliny cząsteczek na odsłoniętych nanocząstkach. Kolejną zaletą jest to, że AFM nie wymaga fluorescencji ani izotopu znakowanie lipidów, ponieważ końcówka sondy oddziałuje mechanicznie z powierzchnią dwuwarstwy. Z tego powodu ten sam skan może ujawnić informacje zarówno o dwuwarstwie, jak i wszelkich powiązanych strukturach, nawet w zakresie rozdzielenia poszczególnych białek błonowych. Oprócz obrazowania AFM może również badać mechaniczną naturę małych delikatnych struktur, takich jak dwuwarstwy lipidowe. Jedno z badań wykazało możliwość pomiaru modułu sprężystości poszczególnych nanoskalowych membran zawieszonych na porowatym anodowym tlenku glinu.
Chociaż AFM jest potężnym i wszechstronnym narzędziem do badania dwuwarstw lipidowych, istnieją pewne praktyczne ograniczenia i trudności. Ze względu na delikatną naturę dwuwarstwy, aby uniknąć uszkodzeń, należy stosować bardzo niskie siły skanowania (zwykle 50 pN lub mniej). Ta uwaga jest szczególnie ważna podczas badania systemów metastabilnych, takich jak pęcherzyki zaadsorbowane na podłożu, ponieważ końcówka AFM może wywołać pęknięcie i inne zmiany strukturalne. Należy również zwrócić uwagę na wybór odpowiedniego materiału i przygotowanie powierzchni końcówki AFM, ponieważ powierzchnie hydrofobowe mogą silnie oddziaływać z lipidami i zakłócać strukturę dwuwarstwy.
Mikroskopia elektronowa
W mikroskopii elektronowej wiązka skupionych elektronów oddziałuje z próbką, a nie wiązka światła, jak w tradycyjnej mikroskopii. Elektrony mają znacznie krótszą długość fali niż światło, więc mikroskopia elektronowa ma znacznie wyższą rozdzielczość niż mikroskopia świetlna, potencjalnie aż do skali atomowej. Ponieważ dwuwarstwy lipidowe są ułożone na poziomie molekularnym, ta wyższa rozdzielczość była nieoceniona. W 1960 roku, kiedy wciąż dyskutowano o strukturze dwuwarstwy, to mikroskopia elektronowa umożliwiła pierwszą bezpośrednią wizualizację dwóch nałożonych na siebie ulotek. W połączeniu z technikami szybkiego zamrażania mikroskopia elektronowa została również wykorzystana do badania mechanizmów transportu między- i wewnątrzkomórkowego, na przykład w celu wykazania, że egzocytotyczne są środkami uwalniania chemicznego w synapsach . Często mikroskopia elektronowa jest jedyną techniką sondy o rozdzielczości wystarczającej do określenia złożonych morfologii w skali nanometrowej.
Ograniczenia mikroskopii elektronowej w badaniu struktur lipidów dotyczą przede wszystkim przygotowania próbki. Większość mikroskopów elektronowych wymaga, aby próbka była pod próżnią, co jest niezgodne z hydratacją w temperaturze pokojowej. Aby przezwyciężyć ten problem, próbki można obrazować w kriogenicznych z towarzyszącą im zamrożoną wodą lub można wykonać metaliczny negatyw z zamrożonej próbki. Zwykle konieczne jest również wybarwienie dwuwarstwy związkiem metalu ciężkiego, takim jak tetratlenek osmu lub octan uranylu, ponieważ składniki lipidów o niskiej masie atomowej (węgiel, azot, fosfor itp.) Dają niewielki kontrast w porównaniu z wodą. Jeśli transmisyjny mikroskop elektronowy (TEM), konieczne jest również pocięcie lub wypolerowanie próbki na bardzo cienki (<1 mikrometr) arkusz, co może być trudne i czasochłonne. Skaningowa mikroskopia elektronowa (SEM) nie wymaga tego kroku, ale nie może zaoferować takiej samej rozdzielczości jak TEM. Obie metody są technikami wrażliwymi na powierzchnię i nie mogą ujawnić informacji o głęboko zakopanych strukturach.
Rozpraszanie neutronów i promieniowania rentgenowskiego
Zarówno promieniowanie rentgenowskie, jak i wysokoenergetyczne neutrony są wykorzystywane do badania struktury i okresowości struktur biologicznych, w tym dwuwarstw, ponieważ można je dostroić do interakcji z materią w odpowiednich skalach długości (angstremów-nm). Często te dwie klasy eksperymentów dostarczają uzupełniających się informacji, ponieważ każda z nich ma inne zalety i wady. Promienie rentgenowskie oddziałują tylko słabo z wodą, więc próbki masowe można badać przy stosunkowo łatwym przygotowaniu próbki. Jest to jeden z powodów, dla których rozpraszanie promieniowania rentgenowskiego było techniką zastosowaną po raz pierwszy do systematycznego badania odstępów między warstwami. Rozpraszanie promieniowania rentgenowskiego może również dostarczyć informacji o średniej odległości między osobnikami lipidów , co doprowadziło do jego zastosowania w charakteryzowaniu przejść fazowych . Jednym z ograniczeń technik rentgenowskich jest to, że promienie rentgenowskie są stosunkowo niewrażliwe na pierwiastki świetlne, takie jak wodór. Efekt ten jest konsekwencją faktu, że promieniowanie rentgenowskie oddziałuje z materią poprzez rozpraszanie gęstości elektronowej, która maleje wraz ze spadkiem liczby atomowej. W przeciwieństwie do tego, neutrony rozpraszają się od gęstości jądrowej i jądrowych pól magnetycznych, więc czułość nie zmniejsza się monotonicznie wraz z z . Mechanizm ten zapewnia również w niektórych przypadkach silny kontrast izotopowy, zwłaszcza między wodorem a deuterem , umożliwiając naukowcom dostrojenie eksperymentalnej linii bazowej poprzez zmieszanie wody i wody deuterowanej. Korzystanie z reflektometrii zamiast rozpraszania za pomocą neutronów lub promieni rentgenowskich umożliwia eksperymentatorom sondowanie obsługiwanych dwuwarstw lub stosów wielowarstwowych. Pomiary te są bardziej skomplikowane do przeprowadzenia analizy, ale pozwalają określić skład przekroju, w tym lokalizację i stężenie wody w dwuwarstwie. W przypadku zarówno pomiarów rozpraszania neutronów, jak i promieniowania rentgenowskiego, dostarczane informacje są średnią zespołową systemu i dlatego podlegają niepewności wynikającej z fluktuacji termicznych w tych wysoce ruchomych strukturach.

