Dunaliella
|
|
|
|
| Dunaliella | |
|---|---|
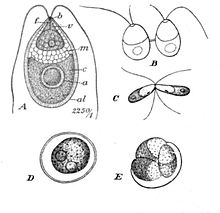
| Dunaliella salina Teodor. A: Komórka wegetatywna, B: Zoospory w podziale komórkowym, C: Gamety godowe, D: Dojrzała zygospora, E: Kiełkowanie zygospory | |
| Klasyfikacja naukowa | |
| (nierankingowe): | Viridiplantae |
| Dział: | Chlorofity |
| Klasa: | chlorophyceae |
| Zamówienie: | Chlamydomonadale |
| Rodzina: | Dunaliellaceae |
| Rodzaj: |
Dunaliella Teodoresco |
| Wpisz gatunek | |
|
Dunaliella salina Teodoresco ( Dunal )
|
|
| Gatunek | |
|
|
|
Dunaliella to jednokomórkowa, fotosyntetyzująca zielona alga , która charakteryzuje się zdolnością do konkurowania z innymi organizmami i rozwijania się w środowisku hipersalinowym . Jest to głównie organizm morski, chociaż istnieje kilka gatunków słodkowodnych, które są rzadsze. Jest to rodzaj , w którym niektóre gatunki mogą akumulować stosunkowo duże ilości β- karotenoidów i glicerolu w bardzo trudnych warunkach wzrostu, na które składają się duże natężenie światła, wysokie stężenie soli oraz ograniczony poziom tlenu i azotu, mimo to nadal występuje bardzo licznie w jeziorach i lagunach na całym świecie.
Rozróżnianie i interpretacja gatunków tego rodzaju staje się bardzo skomplikowane na poziomie morfologicznym i fizjologicznym ze względu na brak ściany komórkowej organizmu, która pozwala mu na plastyczność i zmianę kształtu oraz różne pigmenty , które pozwalają mu zmieniać kolory w zależności od warunków środowiskowych warunki. Analiza filogenezy molekularnej stała się krytycznym protokołem w odkrywaniu taksonomii Dunaliella . Rodzaj był badany przez ponad sto lat, stając się krytycznym organizmem modelowym do badania procesów adaptacji soli glonów. Pozostała aktualna ze względu na liczne zastosowania biotechnologiczne, w tym produkty kosmetyczne i spożywcze β-karotenoidów, medycynę i badania nad biopaliwami .
Historia wiedzy
Dunaliella została pierwotnie nazwana Haematococcus salinus przez francuskiego botanika Michela Félixa Dunala , który po raz pierwszy zauważył ten organizm w 1838 roku w stawach solnych w Montpellier we Francji. Jednak kiedy organizm został oficjalnie opisany i oznaczony jako nowy i odrębny rodzaj w 1905 r. w Bukareszcie w Rumunii przez Emanoila C. Teodorescu , nazwa została zmieniona na Dunaliella na cześć pierwotnego odkrywcy. Aby opisać rodzaj, Teodoresco zbadał żywe próbki z rumuńskich słonych jezior i odnotował szczegóły, takie jak kolory, ruch i ogólna morfologia.
Rodzaj został również opisany przez innego biologa w 1905 r., Clarę Hamburger w Heidelbergu w Niemczech, ale niestety praca Teodoresco została opublikowana jako pierwsza, gdy była na końcowych etapach tworzenia własnego artykułu. Opis Hamburger był dokładniejszy, ponieważ badała materiał importowany z Cagliari na Sardynii i była w stanie badać zarówno żywy, jak i martwy materiał oraz mogła tworzyć sekcje, aby zobaczyć zawartość komórek wewnętrznych, a także opisywać różne etapy życia.
przeprowadzono różne inne badania nad Dunaliellą . Do godnych uwagi należą artykuł Cavary z 1906 r., Rozszerzający badania przeprowadzone przez Hamburgera w Cagliari na Sardynii, artykuł Peirce'a z 1914 r. Na temat Dunaliella w Salton Sea w Kalifornii, różne ekologiczne badania Labbé dotyczące alg w solniskach Le Croisic we Francji, Becking i in. badania organizmów Dunaliella z całego świata oraz pogłębione badania taksonomiczne Hamel i Lerche.
W 1906 roku Teodoresco opisał dwa gatunki o nazwach Dunaliella salina i Dunaliella viridis . Odrębne klasyfikacje pochodzą od D. salina , która jest znacznie większa i ma czerwony kolor ze względu na duże ilości pigmentów karotenoidowych. D. viridis został opisany jako mniejszy i zielony. Opisy te zostały szeroko zakwestionowane przez innych biologów, takich jak Hamburger i Blanchard, którzy upierali się, że nie były to różne gatunki, ale po prostu różne etapy życia, w których zielone komórki były formą młodocianą.
Następnie w 1921 roku Labbé przeprowadził badanie, w którym umieścił próbki Dunalielli z solanek w środowisku o niższym zasoleniu i zaobserwował, że organizmy przystosowały się do nowych warunków słodkiej wody i straciły brązowo-czerwony barwnik i stały się bardziej zielone – czyli że czerwony kolor musiał pochodzić z bardzo euryhalinowych komórek wypełnionych chlorofilem, zmieniających kolor na czerwony w ekstremalnie zasolonych warunkach po trwałym uszkodzeniu ich pigmentów chlorofilowych. Obecnie wiadomo, że w rzeczywistości istnieje bardzo niewiele Dunaliella , które mogą gromadzić β-karotenoidy, a te, które to robią, robią to tylko przy dużym natężeniu światła, wysokim zasoleniu i ograniczonych warunkach wzrostu składników odżywczych. Komórki mogą następnie powrócić do koloru od żółtego do zielonego, gdy warunki środowiskowe staną się mniej surowe.
Dzięki jeszcze bardziej dogłębnym badaniom przeprowadzonym przez Lerche i wsp. wiemy teraz, że D. viridis jest w rzeczywistości heterogenną grupą i można ją podzielić na różne gatunki, takie jak D. minuta , D. parva , D. media i D. euchlora , chociaż te grupy są często łączone w jedną i nazywane D. viridis . D. salina jest obecnie uznawana za odrębny gatunek i wkrótce stanie się bardzo ważnym gatunkiem do zastosowań biotechnologicznych.
Dunalielli przeprowadzono różne badania molekularne, aby scharakteryzować jej dokładną filogenezę. Stało się oczywiste, choć prawie nie potwierdzone, że w rodzaju istniało wiele błędnie nazwanych kultur i synonimów gatunków, które nie zostały jeszcze opracowane w ramach molekularnych badań taksonomicznych.
Siedlisko i ekologia
halofilne Dunaliella , takie jak D. salina , są znane z tego, że żyją na całym świecie w środowiskach hipersalinowych , takich jak solanki, słone jeziora i stawy krystalizatorów. Niektóre z nich mają niższe stężenie soli (~ 0,05 M), a niektóre są na poziomie nasycenia NaCl (~ 5,5 M) lub bardzo blisko niego. Jego zdolność do rozkwitu w tak szerokim zakresie stężeń soli pozwala mu konkurować z większością innych organizmów w swoim środowisku, ponieważ ich tolerancje często nie są tak wysokie. Chociaż rodzaj i jego gatunki są badane od ponad stu lat, bardzo niewiele wiadomo na temat ich dokładnej dynamiki ekologicznej w określonych warunkach środowiskowych i innych organizmów. W większości są morskie, jednak istnieje kilka słodkowodnych gatunków Dunaliella , które mają o nich jeszcze mniej informacji pod względem ekologicznym. Wiadomo jednak, że w ekosystemach hipersalinowych Dunaliella jest krytycznym producentem pierwotnym, który umożliwia przetrwanie innym organizmom, takim jak filtratory i różne organizmy planktonowe. Organizmy mogą prawie całkowicie lub całkowicie polegać na węglu, który wiążą fotosyntetyczne algi. Warto zauważyć, że jest to ważne pożywienie dla planktonu solankowego Artemia , do tego stopnia, że wzrost populacji artemii często koreluje ze spadkiem populacji Dunaliella .
W Wielkim Jeziorze Słonym Dunaliella jest bardzo istotnym organizmem, szczególnie w północnym ramieniu, gdzie jest głównym lub prawdopodobnie jedynym głównym producentem, oraz w południowym ramieniu, gdzie jest znaczącym składnikiem społeczności fototroficznej.
W latach siedemdziesiątych Dunaliella zdominowała zbiorowisko planktonu na północnym ramieniu, ponieważ wody były zbyt słone, aby inne glony mogły się rozwijać. Organizmy były rozmieszczone poziomo i raczej losowo na powierzchni, zwłaszcza w miejscach o minimalnym nasłonecznieniu, takich jak pod skałami i kłodami. Stwierdzono je w gęstościach 200-1000 komórek/ml, a czasami w szczytowych gęstościach 3000-10000 komórek/ml. Czasami stwierdzono nawet, że było ich więcej na głębszych głębokościach, chociaż niewiele wiadomo, czy było to spowodowane nieznośnym natężeniem światła na powierzchni. Nawet w mniej zasolonym południowym ramieniu Dunaliella była odpowiedzialna za różne krótkotrwałe zakwity z liczbą do 25 000 komórek/ml. Niestety populacje w obu ramionach spadły po okresach zwiększonych opadów, które zmniejszyły zasolenie Wielkiego Jeziora Słonego. Dunaliella zaczęła konkurować z innymi fototrofami, takimi jak sinica Nodularia .
Donoszono, że w miesiącach zimowych, kiedy temperatura osiąga 0°C, na dnie Wielkiego Jeziora Słonego gromadzi się duża liczba okrągłych komórek przypominających cysty. Ta właściwość otorbienia Dunalielli musiała mieć kluczowe znaczenie dla jej przetrwania w Morzu Martwym, gdzie stężenie soli wzrosło do niemożliwych do zniesienia ilości, tak że obecnie nie można znaleźć tego organizmu w słupie wody. Jednak w teledetekcji odkryli, że kiedy rozcieńczyli górne wody, pojawiła się Dunaliella; być może wynurzając się z płytkich osadów, w których się otorbiły. Jednak w czasach, gdy glony znajdowały się w słupie wody, monitorowanie populacji wykazało, że Dunaliella był hamowany przez wysokie stężenia jonów magnezu i wapnia. Zakwity Dunaliella mogą zatem wystąpić w Morzu Martwym tylko wtedy, gdy wody zostaną wystarczająco rozcieńczone przez zimowe deszcze i gdy dostępne będą ograniczające fosforany odżywcze.
Gatunek Dunaliella , zwłaszcza D. salina, jest odpowiedzialny i dość znany z przekształcania jezior i lagun w różowe i czerwone kolory, takie jak Pink Lake w Australii. Środowiska hipersalinowe są zdominowane przez pigmenty β-karotenoidowe i pojawiają się dość wyraźnie.
Morfologia i procesy komórkowe
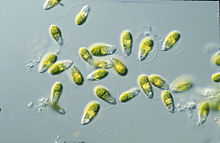
Dunaliella to biflagellate zielony alg i głównie morski protista, który w swojej ruchliwej formie wegetatywnej i w zależności od gatunku wykazuje kształty elipsoidalne, jajowate i cylindryczne, które czasami zwężają się na tylnym końcu. Może również wykazywać bardziej okrągłe kształty w stanie wegetatywnej nieruchliwej cysty. Komórki mają zazwyczaj długość 7–12 μm , chociaż istnieje kilka gatunków większych lub mniejszych. Na przykład D. salina ma większy rozmiar, zwykle w zakresie od 16–24 μm. Rozmiary komórek różnią się w zależności od warunków środowiskowych, takich jak światło, zasolenie i dostępność składników odżywczych.
wici wierzchołkowe o równej długości mają około 1,5-2 razy długość komórki i szybko biją, ciągnąc komórkę do przodu, powodując gwałtowne ruchy obrotowe i obroty wzdłuż osi podłużnej. Ciała podstawowe wici są połączone dystalnym włóknem, które jest obustronnie poprzecznie prążkowane.
Morfologia Dunaliella jest bardzo podobna do Chlamydomonas , jednak wyróżnia się brakiem ściany komórkowej i kurczliwych wakuoli . Zamiast sztywnej ściany komórkowej, plazmalemma Dunalielli ma zauważalną grubą, śluzowatą powłokę . Olivera i in. zauważył, że na powłokę komórkową miały wpływ enzymy proteolityczne i neuraminidaza i doszedł do wniosku, że jej skład musi składać się głównie z glikoproteiny z pewnymi resztami kwasu neuraminowego . Zamiast kurczliwych wakuoli, morskie gatunki Dunaliella zastępują zwykłe miejsce organelli w większości innych komórek Chlorophyceae, dwoma do trzema dictyostomami, które leżą w charakterystycznej pozycji przypodstawnej, z formującymi się twarzami skierowanymi w stronę plazmalemmy i ER.
Dunaliella składają się z dużego plastydu w kształcie kubka , który zajmuje większość komórki. Jego duży pyrenoid, który znajduje się w centrum chloroplastu , jest kolejną charakterystyczną cechą, która jest taka sama u wszystkich gatunków Dunaliella . Jest pokryty skorupą skrobiową z licznymi ziarnami skrobi i parami tylakoidów wchodzącymi, ale nie przechodzącymi całkowicie przez zewnętrzną część pirenoidu do jej macierzy. Ziarna skrobi są również rozproszone po całym chloroplastach. W zależności od tego, jak wysokie jest natężenie światła i stężenie soli, tylakoidy mogą tworzyć stosy zawierające do dziesięciu jednostek. W błonach tylakoidów β-karotenoidy mogą gromadzić się, zwłaszcza w warunkach dużego zasolenia i natężenia światła, w kuleczkach oleju. Pigmenty składają się z neutralnych lipidów i nadają zielonej aldze barwę od pomarańczowej do czerwonej i brązowej. Nagromadzenie β-karotenoidów służy ochronie komórek w środowiskach o dużym natężeniu światła poprzez pochłanianie i rozpraszanie nadmiaru światła lepiej niż chlorofil. W łagodniejszych warunkach pigmenty chlorofilowe sprawiają, że komórki wyglądają na żółte do zielonych. Chloroplast Dunaliella ma również plamkę oczną, która znajduje się w przedniej pozycji obwodowej i składa się z jednego do dwóch rzędów lipidów.
Powodem, dla którego Dunaliella może być tak halotolerancyjna, jest jej bardzo skuteczny proces osmoregulacyjny. Po pierwsze, brak ściany komórkowej umożliwia komórce łatwe rozszerzanie się i kurczenie w celu utrzymania żywych wewnętrznych stężeń soli. Po drugie, wywołane zmianami objętości komórek i poziomów nieorganicznego fosforanu i pH po szoku osmotycznym , czujniki błony komórkowej i różne rozpuszczalne metabolity aktywują syntezę glicerolu. Wytwarzany w procesie fotosyntezy lub degradacji skrobi, glicerol wewnątrzkomórkowy umożliwia komórkom przystosowanie się do wysokiego stresu osmotycznego poprzez zrównoważenie ciśnienia zewnętrznego i ciśnień, a tym samym zapobiega pęcznieniu komórek.
Słodkowodne gatunki Dunaliella są znacznie rzadsze, a zatem mniej zbadane. Ich opisy prawie się nie zmieniły od czasu ich oryginalnych publikacji, a różne nadal są przedmiotem dyskusji, czy uzasadniają klasyfikację jako Dunaliella , ponieważ niektóre gatunki mają inaczej rozmieszczone pyrenoidy, brakujące plamki oczne, nietypowy podział komórek itp.
Jądro Dunalielli leży mniej więcej centralnie w przedniej części komórki i ma określone jąderko. Wokół niego leżą kropelki lipidów i wakuole, zasłaniając je i utrudniając obserwację.
Koło życia
Gdy warunki są niesprzyjające z powodu długotrwałej suszy lub ekspozycji na wody o niskim zasoleniu, komórki Dunaliella ulegają rozmnażaniu płciowemu. Dwie haploidalne, ruchliwe komórki wegetatywne dotykają wici, a następnie łączą ze sobą gamety tej samej wielkości w bardzo podobny sposób jak Chlamydomonas , tworząc mostek cytoplazmatyczny. Po tym izogamicznym zapłodnieniu, diploidalna zygota, która jest koloru czerwonego i/lub zielonego, rozwija grubą i gładką ścianę i przybiera okrągły kształt bardzo podobny do cysty Dunaliella . W rzeczywistości, po zaobserwowaniu zygot, wywiązała się dyskusja, czy cysty obserwowane po rozkwicie glonów w Morzu Martwym w 1992 r. były w rzeczywistości zygotami. Ściana zygoty będzie służyć do ochrony komórki w okresie spoczynku w trudnych warunkach, aż w końcu zygota przejdzie mejozę i uwolni do 32 haploidalnych komórek potomnych poprzez rozdarcie w otoczce komórkowej. Bezpłciowe torbiele spoczynkowe mogą być możliwe, chociaż nie zostały wystarczająco zbadane, aby to potwierdzić.
W stanie wegetatywnej ruchliwości komórki dzielą się przez mitozę jako haploidy przez rozszczepienie podłużne. W chloroplastach pyrenoid faktycznie zaczyna się dzielić najpierw podczas preprofazy, a następnie cały chloroplast ostatecznie dzieli się podczas cytokinezy.
Podejście genetyczne
W przeszłości opisy i definicje gatunków powstawały na podstawie cech fizjologicznych, takich jak halotolerancja i cech morfologicznych, takich jak zawartość β-karotenu. Doprowadziło to jednak do wielu błędnych identyfikacji, zwłaszcza u gatunków morskich, ponieważ różne warunki zmieniające objętość, kształty i kolory komórek bardzo utrudniają rozstrzygnięcie, który organizm różni się od drugiego. Od 1999 r. analiza molekularna jest podstawowym narzędziem Dunallieli ze względu na jej zdolność do analizowania danych niezależnie od czynników środowiskowych 11 . Aby scharakteryzować gatunki, stosuje się gen 18S rRNA , wewnętrzny transkrybowany region rozdzielający (ITS) i karboksylazę rybulozo-bisfosforanową (RuBisCO). Zmiana nazwy została już dokonana dla kilku gatunków, chociaż jest to ciągły proces tworzenia wiarygodnego i dokładnego systemu taksonomicznego.
Praktyczne znaczenie
Z ekonomicznego punktu widzenia Dunaliella , zwłaszcza D. salina i D. bardawil , ma wielką wartość ze względu na wysoką akumulację β-karotenoidów. Pigment jest wykorzystywany do różnych zastosowań, takich jak kosmetyki, naturalne barwniki spożywcze, suplementy diety i pasza dla zwierząt. Jest również stosowany do oczyszczania szkodliwych oczyszczalni ścieków poprzez adsorpcję, sekwestrację i metabolizowanie jonów metali ciężkich. Jego potencjał biotechnologiczny był od dawna wykorzystywany, odkąd stwierdzono, że niektóre gatunki mogą mieć do 16% swojej suchej masy złożonej z β-karotenoidów, a jeziora i laguny, które zmieniają kolor na różowy lub czerwony, zawierają bardzo duże populacje D. salina które stanowią aż 13,8% suchej materii organicznej - na przykład w Pink Lake, Victoria, Australia.
Dunaliella służy również jako bardzo ważny organizm modelowy w zrozumieniu, w jaki sposób glony przystosowują się do różnych stężeń soli i regulują je. W rzeczywistości pomysł opracowania substancji rozpuszczonych w celu utrzymania równowagi osmotycznej w innej materii organicznej zrodził się ze zdolności osmoregulacyjnych Dunalielli .
D. salina i D. bardawil są również szeroko badane i obecnie stosowane w biofarmaceutykach. Przykład obejmuje transformacje jądrowe, które doprowadziły do produkcji białka HBsAg. Białko to ma istotne znaczenie epidemiologiczne dla wirusa zapalenia wątroby typu B, jak również może być nośnikiem epitopów dla wielu innych patogenów. Dunaliella jest również stosowana w kontekście medycyny na astmę, egzemę, zaćmę, a nawet raka.
Oprócz zaangażowania w przemysł konsumencki, spożywczy i zdrowotny, Dunaliella staje się również bardzo przydatna w badaniach nad biopaliwami. W szczególności D. salina może gromadzić bardzo duże ilości skrobi i lipidów w stresujących warunkach; z których oba są bardzo ważne w tworzeniu udanych biopaliw. Ponieważ inne rodzaje zielonych alg mają komplikacje w efektywności wzrostu w stresujących warunkach, takich jak środowiska hipersalinowe, D. salina służy jako organizm bardzo pomocny w badaniu optymalnych poziomów stresu dla optymalnych warunków produkcji biomasy.
Linki zewnętrzne
- Preetha K, John L, Subin CS, Vijayan KK (listopad 2012). „Charakterystyka fenotypowa i genetyczna Dunaliella (Chlorophyta) z indyjskich salin i ich różnorodność” . Biosystemy wodne . 8 (1): 27. doi : 10.1186/2046-9063-8-27 . PMC 3598838 . PMID 23114277 .
- Ahmed RA, He M, Aftab RA, Zheng S, Nagi M, Bakri R, Wang C (sierpień 2017). „Zastosowanie bioenergetyczne Dunaliella salina SA 134 uprawianej przy różnych poziomach zasolenia do produkcji lipidów” . Raporty naukowe . 7 (1): 8118. Bibcode : 2017NatSR...7.8118A . doi : 10.1038/s41598-017-07540-x . PMC 5556107 . PMID 28808229 .