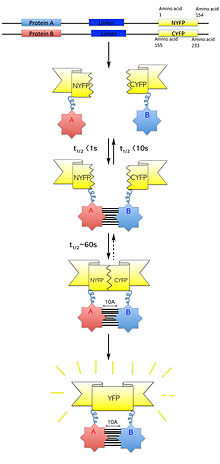
Dwucząsteczkowa komplementacja fluorescencji
Dwucząsteczkowa komplementacja fluorescencyjna (znana również jako BiFC ) to technologia zwykle stosowana do sprawdzania interakcji białek . Opiera się na asocjacji fluorescencyjnych fragmentów białek, które są przyłączone do składników tego samego makrocząsteczkowego . Białka, które mają wchodzić w interakcje, są łączone z niesfałdowanymi komplementarnymi fragmentami fluorescencyjnego białka reporterowego i ulegają ekspresji w żywych komórkach. Interakcja tych białek przybliży fragmenty fluorescencyjne, umożliwiając białku reporterowemu przywrócenie jego natywnej struktury trójwymiarowej i wyemitowanie sygnału fluorescencyjnego. Ten sygnał fluorescencyjny można wykryć i zlokalizować w komórce za pomocą odwróconego mikroskopu fluorescencyjnego , który umożliwia obrazowanie fluorescencji w komórkach. Ponadto intensywność emitowanej fluorescencji jest proporcjonalna do siły oddziaływania, z silniejszymi poziomami fluorescencji wskazującymi na bliskie lub bezpośrednie oddziaływania, a niższymi poziomami fluorescencji sugerującymi oddziaływanie w obrębie kompleksu. Dlatego poprzez wizualizację i analizę intensywności i rozkładu fluorescencji w tych komórkach można zidentyfikować zarówno lokalizację, jak i partnerów interakcji białek będących przedmiotem zainteresowania.
Historia
Biochemiczna komplementacja została po raz pierwszy opisana w bydlęcej rybonukleazie trzustkowej rozszczepionej subtilizyną , a następnie rozszerzona przy użyciu mutantów β-galaktozydazy , które umożliwiły wzrost komórek na laktozie.
Rozpoznanie zdolności wielu białek do spontanicznego składania się w funkcjonalne kompleksy, jak również zdolność fragmentów białek do składania się w wyniku spontanicznego składania funkcjonalnego kompleksu partnerów interakcji, z którymi są one połączone, zostało później zgłoszone dla fragmentów ubikwityny w interakcjach białek drożdży .
W 2000 roku Ghosh i wsp. opracowali system, który umożliwił ponowne złożenie zielonego białka fluorescencyjnego ( GFP ) przy użyciu antyrównoległego suwaka leucynowego w komórkach E. coli . Osiągnięto to przez podzielenie GFP na C- i N-końcowe fragmenty GFP. Ponieważ fragment GFP był przyłączony do każdego zamka leucynowego za pomocą łącznika, heterodimeryzacja przeciwrównoległego zamka leucynowego doprowadziła do zrekonstytuowanego lub ponownie utworzonego białka GFP, które można było zwizualizować. Udany sygnał fluorescencyjny wskazywał, że oddzielne fragmenty peptydu GFP były zdolne do prawidłowego ponownego złożenia i osiągnięcia trzeciorzędowego fałdowania . Dlatego postulowano, że przy użyciu tej techniki pofragmentowany GFP można wykorzystać do badania interakcji par białko-białko , które mają swoje końce NC w bliskiej odległości.
Po wykazaniu udanej rekonstytucji fluorescencyjnego fragmentu białka w komórkach ssaków, Hu i in . opisali zastosowanie fragmentowanego żółtego białka fluorescencyjnego ( YFP ) w badaniu interakcji czynników transkrypcyjnych rodziny bZIP i Rel . Był to pierwszy raport dotyczący regulacji interakcji białek bZIP przez regiony poza domeną bZIP , regulacji lokalizacji podjądrowej domen bZIP Fos i Jun przez ich różnych oddziałujących partnerów oraz modulacji aktywacji transkrypcyjnej białek bZIP i Rel poprzez wzajemne interakcje. Ponadto badanie to było pierwszym raportem techniki in vivo , obecnie znanej jako test bimolekularnej komplementacji fluorescencji (BiFC), w celu zapewnienia wglądu w podstawy strukturalne tworzenia kompleksów białkowych poprzez wykrywanie fluorescencji spowodowanej montażem fluorescencyjnego białka reporterowego fragmenty związane z oddziałującymi białkami.
Etykietowanie fluorescencyjne
fluoroforu następuje poprzez autokatalityczną reakcję cyklizacji, która zachodzi po prawidłowym zwinięciu białka. Zostało to posunięte naprzód dzięki udanej rekonstytucji fluoroforu YFP z fragmentów białek, które zostały połączone z oddziałującymi białkami w ciągu 8 godzin od transfekcji, o czym doniesiono w 2002 roku.
Przepływ pracy
Dobór systemu produkcji białek fuzyjnych
Istnieją różne systemy produkcyjne , które można zastosować do wytworzonego białka fuzyjnego. Przejściowa ekspresja genów jest wykorzystywana do identyfikacji interakcji białko-białko in vivo , jak również w subkomórkowej lokalizacji kompleksu BiFC. Należy jednak uważać na nadekspresję białka, ponieważ może to wypaczyć zarówno preferencyjną lokalizację, jak i utworzone dominujące kompleksy białkowe. Zamiast tego, słabe promotory , zastosowanie niskich poziomów plazmidowego DNA w transfekcji i wektory plazmidowe, które nie replikują się w komórkach ssaków, powinny być użyte do ekspresji białek na poziomie endogennym lub zbliżonym do ich poziomów endogennych, aby naśladować fizjologiczne środowisko komórkowe. Ważny jest również staranny dobór białka fluorescencyjnego, ponieważ różne białka fluorescencyjne wymagają różnych środowisk komórkowych. Na przykład GFP można stosować w E. coli , podczas gdy YFP stosuje się w komórkach ssaków.
Stabilne linie komórkowe z wektorem ekspresyjnym zintegrowanym z genomem umożliwiają bardziej stabilną ekspresję genów w populacji komórek, co skutkuje bardziej spójnymi wynikami.
Wyznaczanie miejsc fuzji
Decydując o miejscu fuzji łącznika na powierzchni białka, należy wziąć pod uwagę trzy główne kwestie. Po pierwsze, fluorescencyjne fragmenty białek muszą być w stanie łączyć się ze sobą, gdy ich uwiązane białka wchodzą w interakcje. Informacje strukturalne i lokalizacja powierzchni interakcji mogą być przydatne przy określaniu miejsca fuzji z łącznikiem, chociaż informacje nie są konieczne, ponieważ można przeszukać wiele kombinacji i permutacji. Po drugie, tworzenie białka fuzyjnego nie może znacząco zmieniać lokalizacji, stabilności lub ekspresji białek, z którymi połączone są fragmenty, w porównaniu z endogennymi białkami typu dzikiego . Wreszcie dodanie fragmentu fuzyjnego fluorescencyjnego nie może wpływać na funkcję biologiczną białka, najlepiej weryfikowaną za pomocą testów oceniających wszystkie znane funkcje białek.
Projektowanie linkerów
Łącznik to krótka sekwencja aminokwasowa , która wiąże fragment fluorescencyjnego białka reporterowego z białkiem będącym przedmiotem zainteresowania, tworząc białko fuzyjne. Projektując sekwencję łącznika, należy upewnić się, że łącznik jest wystarczająco rozpuszczalny i długi, aby zapewnić fragmentom białka fluorescencyjnego elastyczność i swobodę ruchu, tak aby fragment i jego fragment partnerski zderzały się wystarczająco często, aby odtworzyć się podczas interakcji ich odpowiednich fuzji białka. Chociaż nie jest to udokumentowane, możliwe jest, że długość lub sekwencja łącznika może wpływać na komplementację niektórych białek. Zgłoszone sekwencje łącznikowe RSIAT i RPACKIPNDLKQKVMNH (pojedynczy kod aminokwasowy) i AAANSSIDLISVPVDSR (Sigma) zostały z powodzeniem zastosowane w eksperymentach BiFC.
Tworzenie odpowiednich plazmidowych wektorów ekspresyjnych
Projektując wektory plazmidowe do ekspresji białek będących przedmiotem zainteresowania, konstrukt musi być zdolny do ekspresji białek, które są zdolne do tworzenia białek fuzyjnych z fluorescencyjnymi fragmentami białek bez zakłócania funkcji białka. Ponadto oczekiwany kompleks białkowy musi być w stanie zaakceptować stabilizację interakcji fluorescencyjnego fragmentu białka bez wpływu na funkcję kompleksu białkowego lub badaną komórkę. W BiFC można zastosować wiele fluorescencyjnych fragmentów białek, które łączą się na kilka sposobów. Ogólnie zaleca się, aby YFP służyło jako białko reporterowe, przecięte na reszcie 155 (N-końcowa składająca się z reszt 1-154 i C-końcowa składająca się z reszt 155-238) lub w szczególności reszty 173, ponieważ te zestawy fragmentów są wysoce skuteczne w ich uzupełnianiu, gdy są połączone z wieloma oddziałującymi białkami i wytwarzają niski poziom fluorescencji, gdy są połączone z białkami niewchodzącymi w interakcje. Sugeruje się, że każde białko docelowe jest połączone kolejno z N- i C-końcowymi fragmentami fluorescencyjnego białka reporterowego i że fragmenty są połączone z każdym z N- i C-końcowych końców białek docelowych. Umożliwi to w sumie osiem różnych permutacji, z testowanymi interakcjami:
N-końcowy fragment połączony z N-końcowym białkiem 1 + C-końcowy fragment połączony z N-końcowym białkiem 2 N-końcowy fragment połączony z N-końcowym białkiem 1 + C-końcowy fragment połączony z C-końcowym białkiem 2 N-końcowy fragment w fuzji z C-końcowym białkiem 1 + C-końcowy fragment w fuzji z N-końcowym białkiem 2 N-końcowy fragment w fuzji z C-końcowym białkiem 1 + C-końcowy fragment w fuzji z C-końcowym białkiem 2 C-końcowy fragment połączony z N-końcowym białkiem 1 + N-końcowy fragment połączony z N-końcowym białkiem 2 C-końcowy fragment połączony z N-końcowym białkiem 1 + N-końcowy fragment połączony z C-końcowym białkiem 2 C-końcowy fragment połączony z C-końcowym białkiem 1 + N-końcowy fragment połączony z N-końcowym białkiem 2 C-końcowy fragment połączony z C-końcowym białkiem 1 + N-końcowy fragment połączony z C-końcowym białkiem 2
Wybór odpowiedniego systemu hodowli komórkowej
Jak stwierdzono wcześniej, ważne jest, aby upewnić się, że fluorescencyjne białko reporterowe stosowane w BiFC jest odpowiednie i może być wyrażane w wybranym systemie hodowli komórkowej , ponieważ nie wszystkie białka reporterowe mogą fluoryzować lub być wizualizowane we wszystkich systemach modelowych .
Wybór odpowiednich kontroli
Fluorescencyjne fragmenty białek mogą łączyć się i fluoryzować z niską wydajnością przy braku specyficznej interakcji. Dlatego ważne jest uwzględnienie kontroli , aby upewnić się, że fluorescencja z rekonstytucji fluorescencyjnego białka reporterowego nie jest spowodowana niespecyficznym kontaktem.
Niektóre kontrole zawierają fragmenty fluoroforu połączone z niewchodzącymi w interakcje białkami, ponieważ obecność tych fuzji ma tendencję do zmniejszania niespecyficznej komplementacji i wyników fałszywie dodatnich .
Kolejna kontrola jest tworzona przez połączenie fluorescencyjnego fragmentu białka z białkami ze zmutowanymi powierzchniami interakcji. Tak długo, jak fragment fluorescencyjny jest połączony ze zmutowanymi białkami w taki sam sposób jak białko typu dzikiego, a mutacja nie wpływa na poziom ekspresji i lokalizację genu, służy to jako silna kontrola negatywna, ponieważ zmutowane białka i dlatego fragmenty fluorescencyjne nie powinny mieć możliwości interakcji.
Kontrole wewnętrzne są również niezbędne do normalizacji różnic w wydajności transfekcji i ekspresji genów w różnych komórkach. Osiąga się to przez kotransfekcję komórek plazmidami kodującymi białka fuzyjne będące przedmiotem zainteresowania, jak również całe (niefragmentowane) białko, które fluoryzuje przy innej długości fali niż fluorescencyjne białko reporterowe. Podczas wizualizacji wyznacza się intensywność fluorescencji kompleksu BiFC oraz kontrolę wewnętrzną, która po odjęciu sygnału tła staje się stosunkiem. Ten stosunek reprezentuje wydajność BiFC i można go porównać z innymi stosunkami w celu określenia względnych wydajności tworzenia różnych kompleksów.
Transfekcja komórek
Po zaprojektowaniu i wygenerowaniu białek fuzyjnych i kontroli w ich odpowiednim systemie ekspresyjnym, plazmidy muszą zostać transfekowane do komórek, które mają być badane. Po transfekcji należy odczekać, zwykle około ośmiu godzin, aby dać czas białkom fuzyjnym na interakcję i połączone fragmenty fluorescencyjnego białka reporterowego na połączenie i fluorescencję.
Wizualizacja i analiza
Po upływie czasu wystarczającego do interakcji i fluorescencji białek fuzyjnych i powiązanych z nimi fragmentów fluorescencyjnych, komórki można obserwować pod odwróconym mikroskopem fluorescencyjnym, który umożliwia wizualizację fluorescencji w komórkach. Chociaż intensywność fluorescencji kompleksów BiFC jest zwykle <10% intensywności wytwarzanej przez ekspresję nienaruszonych białek fluorescencyjnych, wyjątkowo niska autofluorescencja w zakresie widzialnym, skrajnie większości komórek, często powoduje, że sygnał BiFC jest o rzędy wielkości wyższy niż fluorescencja tła.
Jeśli fluorescencja zostanie wykryta podczas ekspresji białek fuzyjnych, ale jej brak lub jest znacznie zmniejszona po ekspresji zmutowanej kontroli negatywnej, prawdopodobne jest, że zachodzi specyficzna interakcja między dwoma docelowymi białkami będącymi przedmiotem zainteresowania. Jeśli jednak intensywność fluorescencji nie różni się istotnie między zmutowanym białkiem fuzyjnym będącym kontrolą ujemną a jego odpowiednikiem typu dzikiego, wówczas fluorescencja jest prawdopodobnie spowodowana nieswoistymi interakcjami białek, dlatego należy przetestować inną kombinację konformacji białka fuzyjnego.
Jeśli nie zostanie wykryta fluorescencja, interakcja może nadal istnieć między białkami będącymi przedmiotem zainteresowania, ponieważ utworzenie białka fuzyjnego może zmienić strukturę lub powierzchnię interakcji białka docelowego lub fragmenty fluorescencyjne mogą nie być fizycznie zdolne do asocjacji. Aby upewnić się, że ten wynik nie jest fałszywie ujemny , że nie ma interakcji, interakcja białek musi zostać przetestowana w sytuacji, gdy uzupełnienie i aktywacja fluorescencji wymaga zewnętrznego sygnału. W takim przypadku, jeśli sygnał zewnętrzny nie spowoduje asocjacji fragmentów fluorescencyjnych, prawdopodobne jest, że białka nie wchodzą w interakcję lub występuje fizyczna przeszkoda w uzupełnianiu fluorescencji.
Silne strony
Odpowiedni kontekst biologiczny
Białka wchodzą w interakcje z różnymi partnerami białkowymi i innymi makrocząsteczkami, aby osiągnąć funkcje wspierające różne funkcje w komórkach, które wspierają przeżycie organizmu. Identyfikacja tych interakcji może dostarczyć wskazówek co do ich wpływu na procesy komórkowe. Ponieważ na te interakcje może wpływać zarówno środowisko wewnętrzne, jak i bodźce zewnętrzne, badanie tych interakcji in vivo i na poziomie endogennym, zgodnie z zaleceniami BiFC, zapewnia kontekst fizjologiczny, z którego można wyciągnąć wnioski na temat interakcji białek.
Wizualizacja bezpośrednia
BiFC umożliwia bezpośrednią wizualizację interakcji białek w żywych komórkach z ograniczonymi zaburzeniami komórek , zamiast polegać na efektach wtórnych lub barwieniu przez egzogenne cząsteczki, które mogą nie być równomiernie rozprowadzane. To oraz możliwość obserwowania żywych komórek przez długi czas jest możliwe dzięki silnej wewnętrznej fluorescencji odtworzonego białka reporterowego, co zmniejsza szanse na nieprawidłowy odczyt związany z procesem izolacji białka.
Wrażliwość
W przeciwieństwie do wielu testów interakcji białek in vivo , BiFC nie wymaga tworzenia kompleksów białkowych przez dużą część białek lub w proporcjach stechiometrycznych . Zamiast tego BiFC może wykryć interakcje między subpopulacjami białek , słabe interakcje i białka o niskiej ekspresji dzięki stabilnej komplementacji fluorescencyjnego białka reporterowego. Ponadto doniesiono o udanej rekonstytucji białka fluorescencyjnego dla partnerów białkowych oddalonych od siebie o ponad 7 nm, o ile łączniki wiążące fragment fluoroforu z białkiem będącym przedmiotem zainteresowania mają elastyczność potrzebną do asocjacji z odpowiadającym mu fragmentem. Ponadto siłę oddziaływania białek można określić ilościowo poprzez zmiany siły sygnału fluorescencyjnego.
Rozkład przestrzenny
BiFC umożliwia pomiar zmian przestrzennych i czasowych w kompleksach białkowych, nawet w odpowiedzi na leki aktywujące i hamujące oraz subkomórkowo, zapewniając najwyższą rozdzielczość przestrzenną testów interakcji białko-białko in vivo .
Brak specjalistycznego sprzętu
BiFC nie wymaga specjalistycznego sprzętu, ponieważ wizualizacja jest możliwa za pomocą odwróconego mikroskopu fluorescencyjnego, który może wykryć fluorescencję w komórkach. Ponadto analiza nie wymaga skomplikowanego przetwarzania danych ani korekcji dla innych źródeł fluorescencji.
Nie są potrzebne żadne informacje strukturalne
BiFC można przeprowadzić bez informacji strukturalnych o partnerach interakcji, o ile fragmenty fluorescencyjnego białka reporterowego mogą łączyć się w kompleksie, ponieważ można przeszukiwać wiele kombinacji białek fuzyjnych. Wynika to z założenia, że ponieważ funkcje białek są rekapitulowane w in vivo , złożona struktura będzie przypominać nienaruszone białka widziane fizjologicznie.
Wiele aplikacji
Technologia BiFC została udoskonalona i rozszerzona o możliwości jednoczesnej wizualizacji wielu kompleksów białkowych w tej samej komórce , interakcji RNA/białko , szybkiego wykrywania zmian w szlakach transdukcji genów, demonstrowania ukrytych fenotypów leków , gdzie przewidywany wynik leczenia (tj. śmierć komórki, różnicowanie, zmiana morfologiczna) nie są obserwowane in vivo , badanie tworzenia kompleksów w różnych przedziałach komórkowych oraz mapowanie powierzchni interakcji białek
Ograniczenia
Wykrywanie w czasie rzeczywistym
Sygnał fluorescencyjny jest generowany dopiero po interakcji białek, która na ogół jest rzędu godzin. Dlatego BiFC nie jest w stanie zapewnić wykrywania interakcji białek w czasie rzeczywistym. Opóźnienie reakcji chemicznych prowadzących do wytworzenia fluoroforu może również mieć wpływ na dynamikę złożonej dysocjacji i wymiany partnerów.
Nieodwracalna formacja BiFC
Tworzenie kompleksu BiFC jest odwracalne tylko podczas początkowego etapu ponownego składania fluorescencyjnego białka reporterowego, zwykle w ciągu milisekund. Po odtworzeniu fluorochromu jest on zasadniczo nieodwracalny in vitro . Zapobiega to interakcji białek z innymi i może zakłócać asocjację / dysocjację kompleksów białkowych w równowadze dynamicznej .
Niezależne asocjacje fragmentów białek fluorescencyjnych
Fluorescencyjne fragmenty białek mają ograniczoną zdolność asocjacji niezależnie od białek, z którymi są połączone. Chociaż asocjacja niezależna od białka będzie się różnić w zależności od tożsamości białek fuzyjnych i ich poziomów ekspresji, należy zapewnić niezbędne i liczne kontrole, aby odróżnić prawdziwe i fałszywie dodatnie interakcje białek. Ogólnie, to ograniczenie jest łagodzone przez zapewnienie, że białka fuzyjne będące przedmiotem zainteresowania ulegają ekspresji w stężeniach endogennych.
Zmiana struktury białek i zawada przestrzenna
Wiązanie fragmentów fluorescencyjnych może zmienić fałdowanie lub strukturę białka będącego przedmiotem zainteresowania, prowadząc do wyeliminowania powierzchniowego miejsca wiązania oddziałującego białka. Ponadto układ fragmentów fluorescencyjnych może zapobiegać rekonstytucji fluoroforu przez zawadę przestrzenną , chociaż zawadę steryczną można zmniejszyć lub wyeliminować, stosując sekwencję łącznika, która zapewnia wystarczającą elastyczność fragmentom fluorescencyjnym do asocjacji. Dlatego brak komplementacji fluorescencyjnej może być wynikiem fałszywie ujemnym i niekoniecznie dowodzi, że dana interakcja nie występuje.
Obowiązkowe beztlenowce
Ze względu na zapotrzebowanie na tlen cząsteczkowy do tworzenia fluoroforów, BiFC nie może być stosowany u bezwzględnych beztlenowców , które nie mogą przetrwać w obecności tlenu. Ogranicza to zastosowanie BiFC do organizmów tlenowych .
Autofluorescencja
Autofluorescencja zwykle nie stanowi problemu, ponieważ sygnał BiFC będzie znacznie wyższy niż tło. Jednak niektóre organizmy, zwłaszcza apicomplexa , mają wyższą autofluorescencję, co utrudnia zastosowanie w nich BiFC. Niektóre grzyby, takie jak Candida albicans , również mają silne autofluorescencyjne tło, ale BiFC często nadal można przeprowadzić, gdy stosowane są odpowiednie kontrole i szczepy.
Wykorzystanie białek fuzyjnych
Ponieważ endogennych białek typu dzikiego nie można uwidocznić in vivo , należy stworzyć białka fuzyjne i transfekować ich plazmidy do badanych komórek. Te białka fuzyjne mogą nie rekapitulować funkcji, lokalizacji i interakcji typowych dla ich odpowiedników typu dzikiego, zapewniając niedokładny obraz danych białek. Problem ten można złagodzić, wykorzystując informacje strukturalne i lokalizację miejsc interakcji do racjonalnej identyfikacji miejsc fuzji na białkach będących przedmiotem zainteresowania, stosując odpowiednie kontrole i porównując poziomy ekspresji i funkcje białek fuzyjnych i białek typu dzikiego za pomocą Western Blot i funkcjonalnych testy.
Zależność temperaturowa
Chociaż niskie temperatury sprzyjają odtwarzaniu fluorescencji, gdy fragmenty znajdują się w pobliżu, może to wpływać na zachowanie docelowych białek, prowadząc do niedokładnych wniosków dotyczących natury interakcji białek i ich partnerów interakcji.
Dokładny związek interakcji nieznany
Ponieważ rekonstytucja fluoroforu może zachodzić w odległości 7 nm lub większej, komplementacja fluorescencji może wskazywać na bezpośrednią lub pośrednią (tj. w obrębie tego samego kompleksu) interakcję między białkami fuzyjnymi fragmentów fluorescencyjnych.
Aplikacja
Oprócz opisanej powyżej walidacji interakcji białko-białko, BiFC został rozszerzony i dostosowany do innych zastosowań:
Montaż rybosomów bakteryjnych
System BiFC został zastosowany do rejestracji zdarzeń biogenezy rybosomów w E.coli . Proces składania rybosomów obejmuje zarodkowanie białek rybosomalnych w odpowiedniej kolejności i orientacji. Zaburzenia w montażu mogą prowadzić do defektów strukturalnych podjednostek rybosomów, które w rezultacie nie mogą łączyć się w prawidłowej orientacji, tworząc w pełni funkcjonalne rybosomy. Zatem zdarzenia łączenia podjednostek sygnalizowane pojawieniem się BiFC są łatwym sposobem monitorowania biogenezy rybosomów w przeciwieństwie do pracochłonnych metod profilowania polisomów.
Wielobarwna fluorescencja
Fragmenty białek fluorescencyjnych stosowane w BiFC zostały rozszerzone o kolory niebieski, cyjan, zielony, żółty, czerwony, wiśniowy i Wenus . Ta gama kolorów umożliwiła opracowanie wielobarwnej analizy komplementacji fluorescencji. Ta technika umożliwia jednoczesną wizualizację wielu kompleksów białkowych w tej samej komórce. Ponadto białka zazwyczaj mają dużą liczbę alternatywnych partnerów interakcji. Dlatego też, łącząc fragmenty różnych białek fluorescencyjnych z białkami kandydującymi, można badać konkurencję między alternatywnymi partnerami interakcji w tworzeniu kompleksu poprzez komplementację fragmentów o różnych kolorach fluorescencyjnych.
Interakcje białek wiążących RNA
BiFC został rozszerzony o badanie interakcji białek wiążących RNA w metodzie Rackhama i Browna opisanej jako trójcząsteczkowa komplementacja fluorescencyjna (TriFC). W tej metodzie fragment białka fluorescencyjnego Wenus jest poddawany fuzji z interesującym mRNA , a komplementarna część Wenus jest poddawana fuzji z interesującym białkiem wiążącym RNA . Podobnie jak w przypadku BiFC, jeśli mRNA i białko wchodzą w interakcję, białko Wenus zostanie odtworzone i zacznie fluoryzować. Znana również jako metoda mostkowania RNA, ponieważ fluorofor i inne oddziałujące białka tworzą mostek między białkiem a RNA będącym przedmiotem zainteresowania, umożliwia to proste wykrywanie i lokalizację interakcji RNA-białko w żywej komórce i zapewnia prostą metodę wykrywania bezpośrednie lub pośrednie powiązanie RNA-białko (tj. w obrębie kompleksu), które można zweryfikować poprzez analizę in vitro oczyszczonych związków lub knockdown RNAi cząsteczki(-ek) mostkującej(-ych).
Organizacja szlaków i kaskady transdukcji sygnału
BiFC można wykorzystać do łączenia genów ze sobą i ich funkcji poprzez pomiar interakcji między białkami kodowanymi przez geny. Ta aplikacja jest idealna dla nowych genów, w przypadku których niewiele wiadomo o ich efektorach w górę iw dół , ponieważ można utworzyć nowe połączenia szlaków. Ponadto wpływ leków, hormonów lub delecji lub knockdown genu będącego przedmiotem zainteresowania, a następnie wpływ zarówno na siłę interakcji białko-białko, jak i lokalizację interakcji można zaobserwować w ciągu kilku sekund.
Złożona formacja w różnych przedziałach komórkowych
BiFC został wykorzystany do badania translokacji jądrowej poprzez złożoną lokalizację, a także interakcji obejmujących integralne białka błonowe . Zatem BiFC jest ważnym narzędziem w zrozumieniu lokalizacji czynników transkrypcyjnych w przedziałach subkomórkowych.
Kwantyfikacja powierzchni interakcji białko-białko
BiFC połączono z cytometrią przepływową (BiFC-FC). Pozwala to na mapowanie powierzchni interakcji białko-białko poprzez wprowadzenie ukierunkowanych lub losowych mutacji, które wpływają na tworzenie kompleksów.
Porównania do innych technologii
Większość technik stosowanych do badania interakcji białko-białko opiera się na metodach in vitro . Niestety badanie białek w sztucznym systemie, poza ich środowiskiem komórkowym, nastręcza szereg trudności. Na przykład może to wymagać usunięcia białek z ich normalnego środowiska komórkowego. Przetwarzanie wymagane do wyizolowania białka może wpływać na jego interakcje z innymi białkami. Ponadto izolowanie białka z sygnalizacji wewnątrzkomórkowej i mechanizmów zachodzących w normalnej komórce może dostarczyć mylącego obrazu zjawisk wewnątrzkomórkowych i fizjologicznych. Ponadto białka badane in vitro mogą być badane w stężeniach znacznie różniących się od ich normalnych poziomów obfitości, niekoniecznie muszą być skutecznie transportowane do komórek lub mogą nie być wystarczająco selektywne, aby funkcjonować w genomie gospodarza. Wreszcie, badając białka in vitro , nie można określić wpływu określonych interakcji białko-białko w komórce na konsekwencje funkcjonalne lub fizjologiczne.
Inne testy in vivo najczęściej stosowane do badania interakcji białko-białko obejmują transfer energii rezonansu fluorescencji ( FRET ) i test dwuhybrydowy drożdży ( Y2H ). Każdy z tych testów ma swoje zalety i wady w porównaniu z BiFC:
Transfer energii rezonansu fluorescencji (FRET)
Rezonansowy transfer energii fluorescencji ( FRET ), znany również jako rezonansowy transfer energii , rezonansowy transfer energii ( RET ) lub elektroniczny transfer energii ( EET ), opiera się na transferze energii ze wzbudzonego ( donatora ) chromoforu lub fluoroforu (jeśli chromofory są fluorescencyjne) do pobliskiego akceptora . W tej metodzie fluorofory są chemicznie łączone lub genetycznie łączone z dwoma białkami, które przypuszczalnie wchodzą w interakcje. Jeśli białka wchodzą w interakcję, spowoduje to zbliżenie fluoroforów do bliskiej odległości przestrzennej. Jeśli fluorofory są zorientowane w sposób, który wystawia fluorofory na siebie nawzajem, co jest zwykle zapewniane podczas projektowania i konstruowania połączenia/fuzji fluorofor-białko, wówczas przeniesienie energii ze wzbudzonego fluoroforu donorowego spowoduje zmianę intensywności lub czasu życia fluorescencji z fluoroforów.
Drożdże dwuhybrydowe (Y2H)
Drożdże dwuhybrydowe ( Y2H ) to genetyczna technika przesiewowa, którą można wykorzystać do wykrywania fizycznych (wiążących) interakcji białko-białko lub białko-DNA . Zwykle stosuje się go w modelowym organizmie drożdży Saccharomyces cerevisiae . Testuje białko „przynętę” o (nie)znanej funkcji, które jest połączone na przykład z domeną wiążącą czynnika transkrypcyjnego GAL4 przeciwko potencjalnie oddziałującym białkom lub bibliotece cDNA, która wyraża na przykład domenę aktywacyjną GAL4 („ ofiara').
Porównania technologii
| Technologia porównania | Podobieństwo do BiFC | Zalety | Niedogodności | |
|---|---|---|---|---|
| DENERWOWAĆ | Zdolność do wykrywania i lokalizowania miejsc interakcji białek w żywych komórkach |
Natychmiastowe monitorowanie interakcji białek w czasie rzeczywistym
Odwracalna interakcja fluoroforu
|
Bliskie sąsiedztwo przestrzenne
Zmniejszona czułość
Nieodwracalne fotowybielanie
|
|
| R2H | in vivo stosowana do badania interakcji |
Ekran interakcji genetycznych
|
Wstępny związek
Błędna aktywacja transkrypcji
Komplementacja genetyczna
Drożdże jako organizm modelowy
Nadekspresja białek
Lokalizacja jądrowa
|
Linki zewnętrzne
- Kerppola Lab Online – BiFC
- Prezentacja dr CD Hu – Bimolekularna komplementacja fluorescencji (BiFC): zasady i zastosowania