ESCRT
Endosomalne . kompleksy sortujące wymagane do maszynerii transportowej ( ESCRT ) składają się z cytozolowych kompleksów białkowych, znanych jako ESCRT-0, ESCRT-I, ESCRT-II i ESCRT-III Wraz z szeregiem białek pomocniczych, te kompleksy ESCRT umożliwiają unikalny tryb przebudowy błony , który powoduje wyginanie się/pączkowanie błony od cytoplazmy . Te składniki ESCRT zostały wyizolowane i zbadane w wielu organizmach, w tym drożdżach i ludziach. Białko charakterystyczne dla eukariotów , mechanizm ten znajduje się u wszystkich eukariotów i niektórych archeonów .
Mechanizm ESCRT odgrywa istotną rolę w wielu procesach komórkowych, w tym w biogenezie ciałek wielopęcherzykowych (MVB), odcięciu komórek i pączkowaniu wirusów . Biogeneza ciałek wielopęcherzykowych (MVB) to proces, w którym białka znakowane ubikwityną wchodzą do organelli zwanych endosomami poprzez tworzenie pęcherzyków . Ten proces jest niezbędny dla komórek do niszczenia źle sfałdowanych i uszkodzonych białek. Bez maszynerii ESCRT białka te mogą się gromadzić i prowadzić do neurodegeneracyjnych . Na przykład nieprawidłowości w składnikach ESCRT-III mogą prowadzić do zaburzeń neurologicznych, takich jak dziedziczna paraplegia spastyczna (HSP). Odcięcie komórkowe, proces, w którym błona łącząca dwie komórki potomne jest rozszczepiana, również odbywa się za pośrednictwem maszynerii ESCRT. powstałyby nieprawidłowe komórki zawierające dwa razy więcej DNA . Komórki te nieuchronnie zostałyby zniszczone w procesie znanym jako apoptoza . Wreszcie pączkowanie wirusów lub proces, w którym określone typy wirusów opuszczają komórki, może nie wystąpić przy braku maszynerii ESCRT. To nieuchronnie zapobiegłoby rozprzestrzenianiu się wirusów z komórki do komórki.
Kompleksy ESCRT i białka pomocnicze
Każdy z kompleksów ESCRT i białek pomocniczych ma unikalne struktury, które umożliwiają różne funkcje biochemiczne. Istnieje wiele synonimów dla każdego składnika białkowego maszynerii ESCRT, zarówno dla drożdży, jak i metazoanów . Tabela podsumowująca wszystkie te białka znajduje się poniżej.
W drożdżach występują następujące kompleksy/białka pomocnicze:
ESCRT-0
Kompleks ESCRT-0 odgrywa istotną rolę w wytwarzaniu ciałek wielopęcherzykowych poprzez wiązanie i grupowanie ubikwitynowanych białek i/lub receptorów na powierzchni komórki. Kompleks jest następnie odpowiedzialny za wiązanie się z lipidem na błonie endosomalnej, która rekrutuje te znakowane białka do endosomu. Po prawidłowym zlokalizowaniu białka te są następnie przenoszone do endosomu przez pęcherzyki, tworząc ciałka wielopęcherzykowe i ostatecznie dostarczane do lizosomu, gdzie ulegają degradacji. Proces ten jest niezbędny, ponieważ jest głównym szlakiem degradacji uszkodzonych białek, które przeszły przez aparat Golgiego . Składniki kompleksu ESCRT-0 występują w następujący sposób:
Kompleks jest heterodimerem 1:1 Vps27 ( białko sortujące białka wakuolowe 27) i Hse1 . Vps27 i Hse1 dimeryzują przez antyrównoległe domeny GAT o zwiniętej cewce (nazwane tak od białek GGA i Tom1). Zarówno Vps27, jak i Hse1 zawierają domenę VHS na końcu aminowym (nazwaną tak, ponieważ jest zawarta w białkach V ps27, H RS i S TAM). Te domeny VHS wiążą ubikwitynę z białkami, które komórka zamierza zdegradować. Ubikwityna może również wiązać się z motywami oddziałującymi z ubikwityną, takimi jak ten na Hse1 lub domena dwustronna znaleziona na Vps27. Domena FYVE (nazwana na cześć czterech białek, w których została początkowo zidentyfikowana: Fab1p, YOTB, Vac1 i EEA1) znajduje się pomiędzy domenami Vps27 oddziałującymi z VHS i ubikwityną. Fosfatydyloinozytolo-3-fosforan , powszechny lipid endosomalny, wiąże się z tą domeną FYVE, co powoduje rekrutację ESCRT-0 do endosomu.
ESCRT-I
Rolą kompleksu ESCRT-I jest wspomaganie wytwarzania ciałek wielopęcherzykowych poprzez grupowanie ubikwitynowanych białek i działanie jako pomost między kompleksami ESCRT-0 i ESCRT-II. Odgrywa również rolę w rozpoznawaniu i przebudowie błony podczas odcięcia błony, tworząc pierścienie po obu stronach środkowej części dzielących się komórek. ESCRT-I jest również odpowiedzialny za rekrutację ESCRT-III, który tworzy strefę zwężenia tuż przed rozdzieleniem się komórek. Ponadto ESCRT-I odgrywa rolę w pączkowaniu wirusa poprzez interakcję z określonymi białkami wirusowymi, co prowadzi do rekrutacji dodatkowej maszynerii ESCRT do potencjalnego miejsca uwolnienia wirusa. Szczegóły dotyczące maszyn ESCRT-I opisano poniżej.
Kompleks ESCRT-I jest heterotetramerem (1:1:1:1) Vps23, Vps28 , Vps37 i Mvb12. Zmontowany heterotetramer pojawia się jako łodyga w kształcie pręta złożona z Vps23, Vps37 i Mvb12 z wachlarzową czapką złożoną z pojedynczych helis Vps23, Vps28 i Vps37. lanina Vps23 zawiera jedną prolina domenę wariantu E2 ubikwityny, która jest odpowiedzialna za wiązanie ubikwityny treonina , kompleksu ESCRT-0 i motywu PTAP ( , , , prolina ) wirusowych białek Gag . Tuż po tej domenie wariantu ubikwityny E2 obecny jest motyw bogaty w prolinę (GPPX 3 Y), który kieruje ESCRT-I do ciała środkowego podczas odcięcia błony. Mvb12 może również wiązać ubikwitynę poprzez swój koniec karboksylowy . Vps28 jest odpowiedzialny za interakcję ESCRT-I i ESCRT-II poprzez asocjację z domeną GLUE ( GRAM - podobnie jak wiązanie bikwityny U w E AP45) Vps36 poprzez jego domenę wiązki czterech helis na końcu karboksylowym.
ESCRT-II
Kompleks ESCRT-II działa głównie podczas biogenezy ciałek wielopęcherzykowych i dostarczania białek znakowanych ubikwityną do endosomu. Białka znakowane ubikwityną są przekazywane z ESCRT-0 do ESCRT-I, a następnie do ESCRT-II. ESCRT-II łączy się z ESCRT-III, który zamyka ładunek zawierający pęcherzyki. Konkretne aspekty ESCRT-II są następujące:
ESCRT-II jest heterotetramerem (2:1:1) składającym się z dwóch podjednostek Vps25 , jednej Vps22 i jednej podjednostki Vps36 . Cząsteczki Vps25 zawierają motywy PPXY, które wiążą się z motywami skrzydlatej helisy (WH) Vps22 i Vps36, tworząc kompleks w kształcie litery Y z Vps22 i Vps36 jako podstawą i cząsteczkami Vps25 jako ramionami. Cząsteczki Vps25 zawierają również motywy WH, które są odpowiedzialne za oddziaływanie ESCRT-II z ESCRT-III. Vps36 zawiera domenę GLUE, która wiąże 3-fosforan fosfatydyloinozytolu i Vps28 z ESCRT-I. Dwie palca cynkowego są zapętlone w domenie GLUE drożdży Vps36. Jedna z tych domen palca cynkowego wiąże domenę końca karboksylowego Vps28, a druga wiąże się z ubikwityną.
ESCRT-III
Kompleks ESCRT-III jest prawdopodobnie najważniejszym ze wszystkich mechanizmów ESCRT, ponieważ odgrywa rolę we wszystkich procesach, w których pośredniczy ESCRT. Podczas odcięcia błony i pączkowania wirusa, ESCRT-III tworzy długie włókna, które zwijają się wokół miejsca zwężenia błony tuż przed rozszczepieniem błony. Ta mediacja odcięcia zachodzi poprzez interakcje z centralnym kompleksem spindlina . Te nitkowate struktury są również obecne podczas formowania ciał wielopęcherzykowych i działają jak pierścieniowe ogrodzenie, które zatyka pączkujący pęcherzyk, aby zapobiec ucieczce białek ładunkowych do cytozolu komórki. ESCRT-III istnieje i działa w następujący sposób:
Kompleks ESCRT-III różni się od wszystkich innych maszyn ESCRT tym, że istnieje tylko przejściowo i zawiera zarówno istotne, jak i nieistotne elementy. Podstawowe podjednostki muszą się zebrać we właściwej kolejności (Vps20, Snf7, Vps24 , następnie Vps2), aby maszyna mogła działać. Nieistotne podjednostki obejmują Vps60, Did2 i Ist1. Vps20 inicjuje składanie ESCRT-III, działając jako nukleator składania polimeru Snf7. Następnie Vps24 łączy się z Snf7, aby przejąć kontrolę nad kompleksem i rekrutować Vps2. Vps2 następnie przenosi Vps4 do kompleksu. Wszystkie „wolne” formy cytozolowe każdej podjednostki są uważane za zamknięte. Oznacza to, że część karboksy-końcowa każdej podjednostki fałduje się na siebie w sposób autohamujący, stabilizując podjednostki monomeryczne . Koniec karboksylowy większości podjednostek ESCRT-III, zarówno istotnych, jak i nieistotnych, zawiera motywy MIM ( MIT ( mikrotubule oddziałujące i domena transportowa) , oddziałujące motywy ). Motywy te są odpowiedzialne za wiązanie Vps4 i spastyny AAA-ATPazy .
Vps4-Vta1
Białka Vps4-Vta1 są wymagane do usuwania innych składników ESCRT (zwykle ESCRT-III) z błon po zakończeniu określonego procesu. Trwa debata na temat tego, czy Vps4 odszczepia kompleks ESCRT-III, czy też przebudowuje kompleks, tak aby jeden składnik był odrzucany w określonym czasie. Uważa się, że Vta1 działa jako aktywator Vps4, wspomagając jego składanie i wzmacniając aktywność AAA-ATPazy. Sposób działania tych białek jest następujący:
Podjednostki Vps4 mają dwie domeny funkcjonalne, domenę MIT na końcu aminowym i centralną domenę AAA-ATPazy. Domena MIT jest odpowiedzialna za interakcję Vps4 z domeną MIM Vps2. Domena AAA-ATPaza hydrolizuje ATP w celu zasilenia demontażu kompleksu ESCRT-III. To „usunięcie” ESCRT-III umożliwia recykling wszystkich powiązanych podjednostek do dalszego wykorzystania. Vta1 jest dimerycznym białkiem zawierającym jedną domenę VSL (nazwaną tak, ponieważ występuje w białkach V ps4, S BP1 i L IP5), która umożliwia wiązanie się z Vps4 oraz domenę MIT do asocjacji z podjednostką ESCRT-III Vps60. Chociaż nie jest to konieczne, wykazano, że Vta1 pomaga w składaniu pierścienia Vps4, przyspiesza aktywność ATPazy Vsp4 i zachęca do demontażu ESCRT-III.
Brat1
Główną funkcją Bro1 jest rekrutacja deubikwitynaz do kompleksu ESCRT-III. Powoduje to usunięcie znaczników ubikwitynowych z białek przeznaczonych do degradacji w lizosomie tuż przed wytworzeniem ciałek wielopęcherzykowych. Spekulowano również, że Bro1 pomaga stabilizować ESCRT-III, podczas gdy znaczniki ubikwityny są odcinane od białek ładunku.
Bro1 zawiera domenę na końcu aminowym Bro1, która wiąże się z Snf7 ESCRT-III. To wiązanie przenosi Bro1 do miejsca odcięcia błony. Bro1 wiąże również katalityczną Doa4, hydrolazy ubikwityny (deubikwitynazy), przenosząc ją do miejsca odcięcia. Doa4 usuwa ubikwitynę z białek ładunkowych kierowanych do lizosomu.
Biogeneza ciał wielopęcherzykowych i transport ładunków
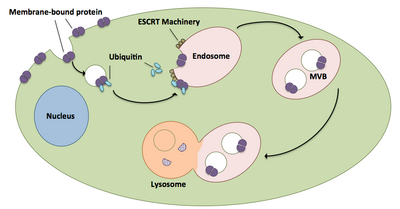
Ciałka wielopęcherzykowe odgrywają dużą rolę w transporcie ubikwitynowanych białek i receptorów do lizosomu. Kompleksy ESCRT transportują ubikwitynowany ładunek do pęcherzyków komórkowych, które pączkują bezpośrednio do przedziału endosomalnego komórki, tworząc ciała wielopęcherzykowe. Te wielopęcherzykowe ciała ostatecznie łączą się z lizosomem, powodując degradację ładunku. Bardziej szczegółowy opis procesu, w tym związanych z nim maszyn, znajduje się w następujący sposób:
- Składniki ESCRT-0, Vps27 i Hse1, wiążą się z ubikwitynowanym ładunkiem.
- Vps27 wiąże się z 3-fosforanem fosfatydyloinozytolu, lipidem endosomalnym, który następnie rekrutuje cały kompleks do endosomu.
- Vps27 wiąże podjednostkę Vps23 ESCRT-I, przenosząc ESCRT-I do endosomu. ESCRT-I może również wiązać białka ubikwitynowane.
- Vps36 łączy się z podjednostką ESCRT-I Vps28, co skutkuje rekrutacją kompleksu ESCRT-II.
- Podjednostka Vps25 ESCRT-II wiąże się i aktywuje Vps20 kompleksu ESCRT-III.
- Vps20 zarodkuje tworzenie nici Snf7, które są następnie zamykane przez Vps24.
- Vps24 rekrutuje Vps2, co przenosi Vps4 do kompleksu.
- Vps4 tworzy pory zbudowane z dwóch heksamerycznych pierścieni, z którymi wiąże się Vta1. Ten kompleks Vps4-Vta1 wyzwala demontaż ESCRT-III i oznacza koniec tworzenia ciałek wielopęcherzykowych.
Odcięcie błony
Odcięcie błony podczas cytokinezy to proces, w którym błona łącząca dwie komórki potomne jest rozszczepiana podczas podziału komórki . Ponieważ jest zachowany w wielu archeonach , uważa się, że odcięcie błony jest najwcześniejszą rolą maszynerii ESCRT. Proces rozpoczyna się, gdy centrosomalne białko Cep55 jest rekrutowane do środkowej części dzielących się komórek w połączeniu z MKLP1, mitotycznym białkiem podobnym do kinezyny, które wiąże się z mikrotubulami. Następnie Cep55 rekrutuje podjednostkę Vps23 ESCRT-I i białko pomocnicze ALIX, które tworzą pierścienie po obu stronach środkowej części ciała. ESCRT-I i ALIX rekrutują ESCRT-III poprzez podjednostkę Snf7. Podjednostki ESCRT-III Vps20, Snf7, Vps24, Vps2 i Did2 tworzą spiralne fibryle sąsiadujące z pierścieniami utworzonymi przez Vps23. Utworzenie tej spiralnej struktury deformuje błonę, a spastyna AAA-ATPazy jest wprowadzana przez Did2 i Ist1 w celu rozszczepienia mikrotubul utworzonych w środkowej części ciała. Vps4 następnie katalizuje rozkład kompleksu ESCRT-III, w wyniku czego powstają dwie nowo rozdzielone komórki potomne. Proces odcięcia błony opisano przy użyciu białek metazoan, ponieważ proces ten był badany w większym stopniu u metazoanów.
Pączkowanie wirusa

Uwalnianie cząstek wirusowych, znane również jako pączkowanie wirusowe , to proces, w którym wolne wiriony są uwalniane z komórek poprzez przejęcie maszynerii ESCRT komórki gospodarza. Retrowirusy , takie jak HIV-1 i ludzki wirus T-limfotropowy , a także wiele wirusów otoczkowych , w tym wirus Ebola , wymagają maszynerii ESCRT, aby opuścić komórkę gospodarza. Proces ten jest inicjowany przez wirusowe białka Gag, główne białka strukturalne płaszcza retrowirusa, które oddziałują z TSG101 kompleksu ESCRT-I i białkiem pomocniczym ALIX. Podjednostki ESCRT-III (istotne są tylko CHMP4 i CHMP2) są rekrutowane do miejsca pączkowania wirusa w celu zwężenia i przecięcia szyjki pąka w sposób podobny do opisanego dla odcięcia błony podczas cytokinezy. Następnie Vps4 zawraca składniki ESCRT-III do cytozolu i wirus jest uwalniany z komórki. Opisany tutaj mechanizm wykorzystuje białka metazoan, ponieważ pączkowanie wirusów było badane bardziej intensywnie w metazoanach.

