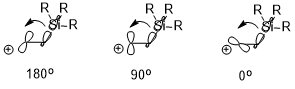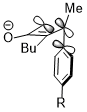Efekt stereoelektroniczny
W chemii , głównie chemii organicznej i obliczeniowej , efekt stereoelektroniczny to wpływ na geometrię cząsteczek , reaktywność lub właściwości fizyczne w wyniku relacji przestrzennych w strukturze elektronowej cząsteczek , w szczególności interakcji między orbitalami atomowymi i / lub molekularnymi . Ujmując inaczej, efekty stereoelektroniczne można również zdefiniować jako ograniczenia geometryczne nałożone na stany podstawowe i/lub stany przejściowe cząsteczek, które wynikają z rozważań na temat nakładania się orbit. Zatem efekt stereoelektroniczny wyjaśnia określoną właściwość molekularną lub reaktywność, wywołując stabilizujące lub destabilizujące interakcje, które zależą od względnej orientacji elektronów (wiązanie lub brak wiązania) w przestrzeni.
Efekty stereoelektroniczne pojawiają się w innych dobrze znanych interakcjach. Obejmują one ważne zjawiska, takie jak efekt anomeryczny i hiperkoniugacja . Należy zauważyć, że efektów stereoelektronicznych nie należy błędnie rozumieć jako prostej kombinacji efektów sterycznych i efektów elektronicznych .
Oparty na kilku ogólnych zasadach rządzących interakcjami orbitali, efekt stereoelektroniczny, wraz z efektem sterycznym, efektem indukcyjnym, efektem rozpuszczalnika, efektem mezomerycznym i aromatycznością, jest ważnym rodzajem wyjaśnienia obserwowanych wzorców selektywności, reaktywności i stabilności w chemii organicznej . Pomimo stosunkowo prostych przesłanek, efekty stereoelektroniczne często dostarczają wyjaśnień sprzecznych z intuicją lub zaskakujących obserwacji. W rezultacie czynniki stereoelektroniczne są obecnie powszechnie brane pod uwagę i wykorzystywane w rozwoju nowej metodologii organicznej oraz w syntezie złożonych celów. Badanie efektów stereoelektronicznych w ostatnich latach wkroczyło również do sfery biochemii i chemii farmaceutycznej .
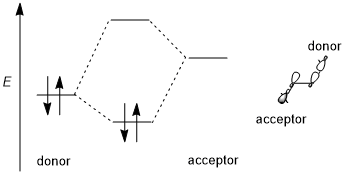
Efekt stereoelektroniczny ogólnie obejmuje stabilizującą interakcję donor-akceptor (tj. wypełnione wiązanie-puste antywiązanie, 2-elektron 2-orbital). Dawcą jest zwykle orbital o wyższym wiązaniu lub niezwiązaniu , a akceptor jest często nisko położonym orbitalem antywiążącym , jak pokazano na poniższym schemacie. O ile to możliwe, jeśli ten efekt stereoelektroniczny ma być faworyzowany, orbitale donorowo-akceptorowe powinny mieć (1) małą przerwę energetyczną i (2) być geometrycznie dobrze rozmieszczone do interakcji. W szczególności oznacza to, że kształty orbitali donorowych i akceptorowych (w tym symetria π lub σ i rozmiar oddziałujących płatów) muszą być dobrze dopasowane do interakcji; jakiś antyperiplanarna jest szczególnie korzystna. Niektórzy autorzy wymagają, aby efekty stereoelektroniczne były stabilizujące. Jednak destabilizujące interakcje donor-donor (tj. wypełnione wiązaniem-wypełnione antywiązaniem, 4-elektron 2-orbital) są czasami przywoływane i są czasami określane jako efekty stereoelektroniczne, chociaż takie efekty są trudne do odróżnienia od ogólnego odpychania sterycznego.
Trend różnych orbitali
jako przykład najprostszy system CH 2 X – CH 3 ; orbital dawcy to orbital σ (C – H), a akceptor to σ * (C – X). Przechodząc od fluoru do chloru , a następnie do bromu , elektroujemność halogenu a poziom energii orbitali σ * (C – X) maleje. W konsekwencji ogólny trend akceptorów można podsumować następująco: π*(C=O)>σ*(C–Hal)>σ*(C–O)>σ*(C–N)>σ*(C–C ), σ*(C–H). W przypadku oddawania orbitali, orbitale niewiążące lub samotne pary są generalnie bardziej skuteczne niż orbitale wiążące ze względu na wysoki poziom energii. Ponadto, w odróżnieniu od akceptorów, orbitale donorowe wymagają mniej spolaryzowanych wiązań. Zatem ogólne trendy dla orbitali dawcy byłyby następujące: n (N)> n (O)> σ (C – C), σ (C – H)> σ (C – N)> σ (C – O)> σ (C–S)>σ(C–Hal).
Efekt stereoelektroniczny może być w określonych przypadkach kierunkowy. Promień siarki jest znacznie większy niż promień węgla i tlenu . Zatem różnice w odległościach wiązań C-S generują znacznie wzmocnioną różnicę w dwóch efektach stereoelektronicznych w 1,3- ditiananie (σ(C-H) → σ*(C-S)) niż w 1,3- dioksanie ( σ(C–H) → σ*(C–O)). Przedstawione poniżej różnice między wiązaniami C – C i C – S powodują znaczną różnicę w odległościach między wiązaniami C – S i dwoma wiązaniami C – H. Im mniejsza różnica, tym lepsza interakcja i silniejszy efekt stereoelektroniczny.
Wpływ na stabilność
w pozycji β karbokationu znajduje się podstawnik elektrododatni (np. –SiR 3 , –SnR 3 , –HgR itp.) , ładunek dodatni może zostać ustabilizowany, co jest również w dużej mierze spowodowane efektem stereoelektronicznym (zilustrowanym poniżej za pomocą – SiR3 jako przykład). Orientacja dwóch oddziałujących orbitali może mieć znaczący wpływ na efekt stabilizacji (σ (C – Si) → pusty orbital p), gdzie antyperiplanarny (180 °)> prostopadły (90 °)> syn (0 °).
Wpływ na budowę
Efekt Gauche’a
Jedną konsekwencją strukturalną systemów acyklicznych wynikającą z efektu stereoelektronicznego jest efekt gauche'a . W 1,2-difluoroetanie , pomimo zderzenia sterycznego, preferowaną konformacją jest konformacja gauche, ponieważ σ(C–H) jest dobrym donorem, a σ*(C–F) jest dobrym akceptorem, a efekt stereoelektroniczny (σ(C –H) → σ*(C–F)) wymaga, aby minimalna energia była słaba zamiast anty.
Ten efekt rozchwiania i jego wpływ na konformację są ważne w biochemii. Na przykład we fragmentach podjednostki HIF-α zawierających ( 2S,4R )-4-hydroksyprolinę oddziaływanie typu gauche faworyzuje konformer, który może wiązać się z miejscem aktywnym pVHL. pVHL pośredniczy w proteasomalnej degradacji HIF1A , a tym samym w odpowiedzi fizjologicznej na niedotlenienie.
Efekty specjalne podstawnika fluorowego
Efekty stereoelektroniczne mogą mieć znaczący wpływ na badania farmaceutyczne . Ogólnie rzecz biorąc, zastąpienie wodoru fluorem można uznać za sposób na dostrojenie zarówno hydrofobowości , jak i stabilności metabolicznej potencjalnego leku. Co więcej, może mieć głęboki wpływ na konformacje, często z powodu efektów stereoelektronicznych, oprócz normalnych efektów sterycznych wynikających z większego rozmiaru atomu fluoru. Na przykład geometrie stanu podstawowego anizolu (metoksybenzenu) i (trifluorometoksy) benzenu różnią się znacznie. W anizolu , grupa metylowa woli być współpłaszczyznowa z grupą fenylową , podczas gdy (trifluorometoksy)benzen preferuje geometrię, w której kąt dwuścienny [C(aryl)–C(aryl)–O–C(F 3 )] wynosi około 90°. Innymi słowy, wiązanie O – CF 3 jest prostopadłe do płaszczyzny grupy fenylowej.
Dalsze badania pokazują, że nawet w przypadku zastąpienia tylko jednego lub dwóch atomów wodoru w grupie metylowej atomem fluoru zniekształcenie struktury może być również znaczące, przy czym [C (aryl) – C (aryl) – O – C ( H 2 F)] kąt dwuścienny w strukturze o zminimalizowanej energii wynosi około 24°, a kąt dwuścienny [C(aryl)–C(aryl)–O–C(HF 2 )] 33°.
Wpływ na selektywność reakcji
Cyklizacje redukcyjne
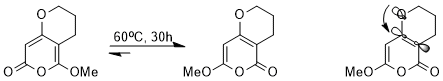
Chociaż różnica energii między współpłaszczyznowym anizolem a jego izomerem jest dość duża, rotacja między wiązaniem O-CH 3 staje się korzystna, gdy trzeba zmienić właściwości elektronowe grupy metoksylowej na pierścieniach aromatycznych, aby ustabilizować niezwykły stan pośredni lub przejściowy. W następującej reakcji regioselektywność można zracjonalizować jako rotację wiązania O – C poza płaszczyzną, która zmienia grupę metoksylową z grupy donorowej w płaszczyźnie na grupę akceptorową poza płaszczyzną.
Produktem pośrednim powyższej reakcji jest dia-anion, a efektem stereoelektronicznym, który stabilizuje ten związek pośredni względem drugiego, jest fakt, że ładunek anionowy w pozycji para może zostać przeniesiony do atomu tlenu poprzez oddziaływanie orbitalne: π (benzen) → σ *(O-CH 3 ).
Uwodornienie
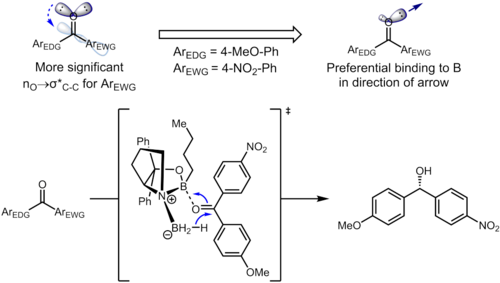
Nawet odległe podstawniki na pierścieniu benzenowym mogą wpływać na gęstość elektronów na pierścieniu aromatycznym, a to z kolei wpływać na selektywność. W uwodornieniu ketonów przy użyciu katalizatorów CBS , keton koordynuje się z atomem boru z samotną parą na atomie tlenu. W poniższym przykładzie indukcyjny wpływ podstawników może prowadzić do zróżnicowania dwóch wolnych par sp2 na atomie tlenu.
Odpowiednie oddziaływanie stereoelektroniczne w materiale wyjściowym to oddziaływanie n O → σ*(C karbonylo - karyl ). Podstawnik odciągający elektrony na pierścieniu benzenowym zmniejsza gęstość elektronów na pierścieniu aromatycznym i tym samym sprawia, że orbital σ*(C karbonyl –C aryl(nitro) ) jest lepszym akceptorem niż σ*(C karbonyl –C aryl(metoksy) ). Te dwie stereoelektroniczne interakcje wykorzystują różne samotne pary na atomie tlenu (jedna przeciwpłaszczyznowa względem omawianego σ * dla każdego), co prowadzi do samotnych par o różnych gęstościach elektronów. W szczególności zwiększone wyczerpywanie się gęstości elektronowej z samotnej pary przeciwpłaszczyznowej do grupy 4-nitrofenylowej prowadzi do osłabienia zdolności tej samotnej pary do koordynowania z borem. To z kolei powoduje, że samotna para antyperiplanarna do 4-metoksyfenylu wiąże się preferencyjnie z katalizatorem, co prowadzi do dobrze określonej selektywności twarzy. W zoptymalizowanych warunkach powstaje produkt o doskonałych poziomach enancjoselektywności (95% ee).
Wpływ na termodynamikę
Wpływ na równowagę
Efekt stereoelektroniczny wpływa na termodynamikę równowagi. Na przykład następującą równowagę można osiągnąć poprzez kaskadę pericyklicznych .
Pomimo bardzo podobnych struktur, jeden z dwóch izomerów jest zdecydowanie faworyzowany w stosunku do drugiego ze względu na efekt stereoelektroniczny. Ponieważ orbital σ* CC sąsiadujący z grupą karbonylową odciągającą elektrony ma niższą energię i dlatego jest lepszym akceptorem niż orbital σ* CC sąsiadujący z grupą metoksylową, izomer, w którym samotna para n O (σ) jest w stanie darowizna na ten orbital antywiążący o niższej energii zostanie ustabilizowany (zilustrowano interakcję orbitalną).
Inny przykład preferencji w równowadze w obszarze reakcji pericyklicznej pokazano poniżej. Efekt stereoelektroniczny, który wpływa na równowagę, to interakcja między zdelokalizowanymi „wiązaniami bananowymi” a pustym orbitalem p na atomie boru.
Wpływ na struktury rezonansowe
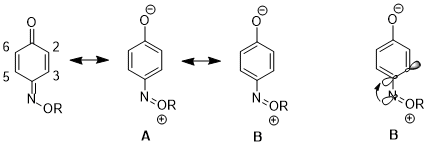
W innym przypadku efekt stereoelektroniczny może skutkować zwiększonym udziałem jednej struktury rezonansowej nad inną, co prowadzi do dalszych konsekwencji w reaktywności . W przypadku monooksymu 1,4- benzochinonu istnieją znaczne różnice we właściwościach fizycznych i reaktywności między wiązaniem podwójnym C2-C3 a wiązaniem podwójnym C5-C6. Na przykład w 1H NMR 3 J 23 wyższe niż 3 J 56. Podwójne wiązanie C2-C3 również selektywnie przechodzi reakcję Dielsa-Aldera z cyklopentadienem , pomimo zwiększonej zawady sterycznej po tej stronie cząsteczki. Dane te ilustrują zwiększony udział struktury rezonansowej B nad strukturą A. Autorzy argumentują, że darowizna z n N na orbital σ* C4-C3 wydłuża wiązanie C4 – C3 (C4 to węgiel niosący podstawnik azotu), co zmniejsza nakładanie się pp między tymi dwoma atomami. To z kolei zmniejsza względne znaczenie struktury A , która ma podwójne wiązanie między C4 i C3.
Zastosowanie w asymetrycznych reakcjach Dielsa-Aldera
W asymetrycznych reakcjach Dielsa-Aldera, zamiast stosowania chiralnych ligandów lub chiralnych środków pomocniczych do różnicowania selektywności bocznej dienofilów, Woodward odnotował zróżnicowanie selektywności twarzy dienów ( zwłaszcza pochodnych cyklopentadienu ) przy użyciu efektów stereoelektronicznych od 1955 roku. Przeprowadzono systematyczne badania selektywności twarzy przy użyciu podstawionych pochodnych cyklopentadienu lub permetylocyklopentadienu, a wyniki można zestawić jak poniżej.
Efektem stereoelektronicznym wpływającym na wynik selektywności twarzy dienu w reakcji Dielsa-Aldera jest oddziaływanie pomiędzy σ(C(sp 2 ) –CH 3 ) (kiedy σ(C(sp 2 ) –X) jest lepszym akceptor niż donor) lub σ(C(sp 2 )–X) (gdy σ(C(sp 2 )–X) jest lepszym donorem niż akceptor) oraz orbital σ* tworzącego się wiązania między dienem a dienofil.
Jeśli oba podstawniki geminalne są pierścieniami aromatycznymi z różnymi podstawnikami dostrajającymi gęstość elektronów, zróżnicowanie selektywności twarzy jest również łatwe, gdy dienofil zbliża się do dienu anty do bardziej bogatego w elektrony wiązania C – C, gdzie efekt stereoelektroniczny w tym przypadek jest podobny do poprzedniego.
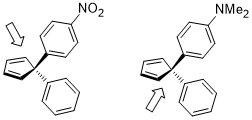
Otwarcie pierścienia cyklobutenu w warunkach ogrzewania może mieć dwa produkty: obrót do wewnątrz i na zewnątrz.
Stan przejściowy rotacji do wewnątrz struktury pokazanej poniżej jest stosunkowo preferowany dla podstawników akceptorowych R (np. NO2 ) , ale jest szczególnie niekorzystny dla podstawników R donorowych (np. NMe2 ) .
Efekt stereoelektroniczny a zderzenie steryczne
Czasami efekty stereoelektroniczne mogą wygrać z ekstremalnymi zderzeniami sterycznymi. W podobnej reakcji otwarcia pierścienia cyklobutenu grupa trimetylosililowa , która jest bardzo masywna, nadal sprzyja rotacji do wewnątrz. Efekt stereoelektroniczny, czyli oddziaływanie pokazane powyżej, gdy orbitalem akceptorowym jest σ*(Si–CH 3 ), wydaje się być bardziej dominującym czynnikiem determinującym selektywność reakcji względem zawady sterycznej, a nawet wygrywa z karą za zakłócenie system koniugacji produktu z powodu zderzenia sterycznego.
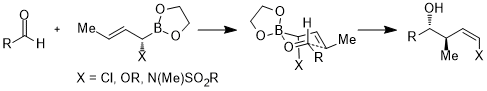
Ponadto orbitale akceptorowe nie są ograniczone do orbitali antywiążących wiązań węgiel-heteroatom lub pustych orbitali; w poniższym przypadku orbitalem akceptorowym jest orbital σ*(B – O). W sześcioczłonowym stanie przejściowym pierścienia oddziaływanie stereoelektroniczne to σ(C – X) → σ*(B – O).
Efekty stereoelektroniczne w biomolekułach
Zdarzenia rozpoznawania molekularnego, w których pośredniczą interakcje orbitalne, mają kluczowe znaczenie w wielu procesach biologicznych, takich jak kataliza enzymatyczna. Stabilizujące interakcje między białkami i węglowodanami w glikozylowanych białkach również ilustrują rolę efektów stereoelektronicznych w biomolekułach.